2. 苏州大学附属第一医院耳鼻咽喉科, 江苏 苏州 215006
2. Department of Otorhinolaryngology, The First Affiliated Hospital of Soochow University, Suzhou 215006, Jiangsu, China
目前,鼻息肉的病因尚不明确,一般认为与各种病原微生物感染、局部变态反应有关。而嗜酸性粒细胞(eosinophil,EOS)的浸润和多种炎症因子的表达也是鼻息肉发生的一个重要环节[1]。Mygidn[2]根据鼻息肉组织中炎性细胞的浸润情况,将鼻息肉分为“中性粒细胞鼻息肉”和“嗜酸性粒细胞鼻息肉”。2001年,有学者提出根据是否伴有EOS浸润将慢性鼻鼻窦炎(chronic rhinosinusitis,CRS)分为嗜酸粒细胞慢性鼻-鼻窦炎(eosinophilic chronic rhinosinusitis,ECRS)和非嗜酸粒细胞慢性鼻-鼻窦炎(non-eosinophilic,non-ECRS)[3, 4]。进一步延伸,鼻息肉亦可分为嗜酸粒细胞性鼻息肉(eosino-philic nasal polyps,ENP)和非嗜酸粒细胞性鼻息肉(non-eosinophilic nasal polyps,NENP)。Ishitoya等[3]研究发现,ENP与NENP在临床症状、CT扫描及治疗等方面存在诸多不同之处,ENP的治疗无论是药物还是手术疗效相对较差,导致其复发率相对较高。Sun等[5]亦认为,ENP术后复发率较高。鼻息肉的复发影响因素众多,故目前对复发性鼻息肉的说法仍存在争议。
炎性因子是炎症体的下游产物,而炎症体是核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain,NOD)样受体家族(NOD-like receptors,NLRs)及其形成的多蛋白水解复合物[6]。由于炎症体能被细菌、病毒、真菌等病原体或危险信号所激活,所以炎症体在多种疾病的发生、发展过程中具有重要作用。近年来研究发现[7],下呼吸道疾病与NLR含热蛋白结构域3(NLRP3)炎性小体密切相关。由于上下呼吸道炎症存在一致性,因此NLRP3炎性小体和其他炎性因子一样共同参与了鼻腔、鼻窦的慢性炎症的发生与发展,但与ENP发病与复发的关系尚不明确。本研究通过观察NLRP3炎性小体在ENP及复发性嗜酸粒细胞性鼻息肉(recurrent eosinophilic nasal polyps,RENP)中的表达来探索其在ENP发病及复发中的作用,以期为ENP的诊断与治疗提供理论依据。
1 资料与方法 1.1 临床资料选取2011年3月至2014年5月南京市高淳人民医院耳鼻咽喉科收治的80例ENP(ENP组)、24例RENP患者(RENP组)的鼻息肉组织及同期30例鼻中隔偏曲患者(对照组)的中鼻甲黏膜。ENP诊断标准:随机选择HE染色切片5个视野,分别计数,每高倍镜视野下EOS计数占总炎性细胞数的10%以上[8]。RENP诊断标准:①功能性鼻内镜手术(functional endoscopic sinus surgery,FESS)史≥2次;②手术结束后半年内再发鼻息肉;③排除支气管哮喘、阿司匹林三联征、免疫功能缺陷等疾病;④术后病理检查确诊为ENP。ENP组男42例,女38例;平均45岁;既往无鼻腔、鼻窦手术史。RENP组男13例,女11例;平均38岁;均行FESS≥2次。对照组男17例,女13例;平均35岁;均行鼻中隔偏曲矫正术时取中鼻甲黏膜组织,新鲜标本行石蜡切片。本研究经医院伦理委员会批准。
1.2 方法 1.2.1 切片制作经甲醛溶液固定组织标本,24 h后以梯度乙醇行脱水处理,以二甲苯行透明处理(≤3 h)。将蜡块放于65 ℃恒温箱内进行30 min透蜡处理后,将组织块包埋于石蜡组织内,使其凝固成块。制备好的蜡块进行连续切片,每标本切片5张,厚度约 4 μm,其中一部分切片行HE常规染色,其余置于多聚赖氨酸载玻片上烘烤2 d(60 ℃)用于免疫组化染色。
1.2.2 HE染色石蜡切片,常规脱蜡水化,苏木素及伊红染色,中性树胶封片。高倍镜(×400)下观察,可见EOS呈圆形,体积较大,细胞质染色呈粉红色,细胞核染色呈深蓝色,通常分成2~3叶,呈眼睛状。随机选取每张切片的5个视野,使用Image-Pro Plus 6.0病理图像分析软件进行计数,计算EOS平均数。
1.2.3 免疫组化采用第三代二步免疫组织化学法,石蜡切片,常规脱蜡水化,高压抗原修复3 min,3%H2O2室温孵育10 min,分别滴加一抗(NLRP3炎性小体1:100、IL-1β 1:100、IL-18 1:100,Santa Cruz),37 ℃孵育90 min;滴加适量二抗工作液,37 ℃孵育20 min,PBS冲洗,2 min×3次;滴加辣根过氧化酶标记的链霉素卵白素工作液,37 ℃孵育30 min,PBS冲洗,2 min×3次;滴加DAB显色剂,室温下显色,显微镜下控制时间;自来水充分冲洗,苏木素复染30 s,1%盐酸乙醇分化,乙醇脱水,二甲苯透明,封片。
1.3 观察指标所有患者EOS浸润数通过HE染色观察并计算,采用免疫组化法检测3组NLRP3炎性小体、IL-1β、IL-18表达情况,并分析ENP、RENP组中NLRP3炎性小体与EOS浸润数的相关性。
1.4 判断标准阳性细胞染色为淡黄、棕黄和棕褐色。NLRP3炎性小体、IL-1β和IL-18阳性染色均定位于细胞浆和细胞核,三者表达在高倍镜下综合染色强度和阳性细胞所占比例行半定量测定。染色强度:无色计0 分,淡黄色计1 分,棕黄色计2 分,棕褐色记3 分;阳性细胞数所占比例:无阳性细胞计 0 分,<25%计 1 分,25%~50%计2 分,51%~75%计3 分,>75%计4分。两者评分相乘,>3分为免疫反应阳性。
1.5 统计学处理采用SPSS17.0软件,3组EOS计数比较采用单因素方差分析,NLRP3炎性小体、IL-1β和IL-18表达比较采用χ2检验,NLRP3炎性小体、IL-1β和IL-18阳性细胞数与EOS浸润数的相关性采用Pearson相关性分析。检验水准取α=0.05,P<0.05为差异有统计学意义。
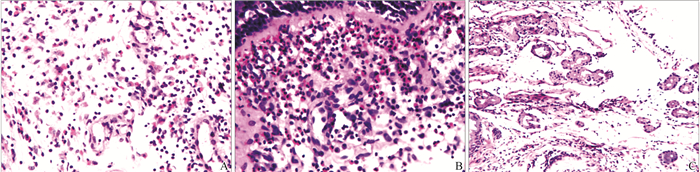
2 结 果 2.1 HE染色ENP组织中黏膜组织结构疏松,间质明显水肿,大量杯状细胞增多,腺体增生。上皮层可见少许纤毛,但部分粘连,倒伏、缺失。皮下间质内及腺体周围可见大量EOS及中性粒细胞浸润(图 1A)。RENP组织结构疏松,间质高度水肿,杯状细胞、腺体显著增生,上皮层纤毛缺如,上皮下间质内及腺体周围可见大量EOS浸润(图 1B)。对照组正常鼻腔黏膜上皮表面光滑平整,无缺损,上皮以假复层纤毛柱状上皮为主,纤毛完整,细胞排列整齐,可见有少许杯状细胞,基底膜层未见增厚,间质无明显水肿,见少量EOS等炎症细胞浸润,腺体无明显增生扩张(图 1C)。
|
图1 HE染色(HE×400) A:ENP组织中可见大量EOS及中性粒细胞浸润;B:RENP组织中可见大量EOS浸润;C:正常鼻腔黏膜见少量EOS浸润。 Fig. 1 HE staining(HE×400) A: A lot of EOS and neutrophil infiltration were observed in ENP tissue; B: A lot of EOS infiltration were observed in RENP tissue; C: Less EOS infiltration was observed in normal nasal mucosa. |
ENP组、RENP组和对照组EOS计数分别为29.88±1.76/HP、39.34±1.83/HP、4.26±0.78/HP。RENP组EOS计数明显高于对照组(P<0.01)和ENP组(P<0.05)。
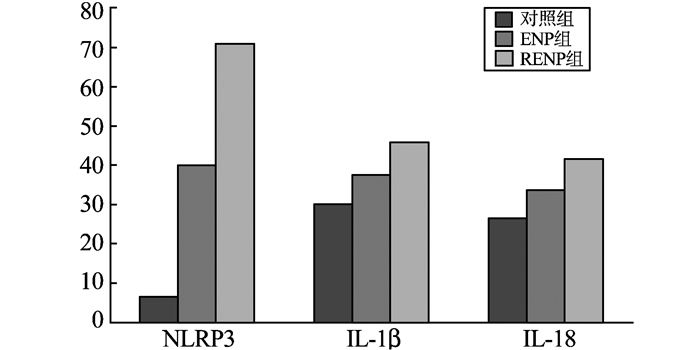
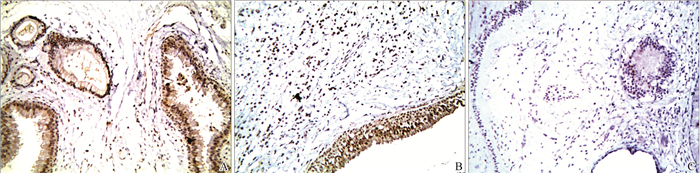
2.3 免疫组化结果NLRP3 炎性小体、IL-1β和IL-18阳性表达均呈棕黄色或棕褐色,位于细胞浆和细胞核,但在3组中的表达率不同(图 2)。NLRP3炎性小体在RENP组大量表达(图 3A),在ENP组较多表达(图 3B),而在正常组表达极少(图 3C);IL-1β在RENP、ENP组表达较多,两者表达情况相似(图 4A、图 4B),但在正常组表达较少(图 4C);IL-18与IL-1β表达情况类似,在RENP、ENP组表达较多(图 5A、图 5B),而在正常组表达较少(图 5C)。
|
图2 3组NLRP3炎性小体、IL-1β和IL-18阳性表达率比较。RENP组NLRP3炎性小体阳性表达率明显高于ENP组和对照组(P<0.01)。3组IL-1β和IL-18阳性表达率比较无显著差异(P>0.05)。 Fig. 2 Positive expressions of NLRP3 inflammasome, IL-1β and IL-18 in the three groups. The expression of NLRP3 inflammasome in the RENP group was significantly higher than that in the ENP group and control group (P < 0.01). The positive expressions of IL-1β and IL-18 in the three groups had no significant difference. |

|
图3 NLRP3炎性小体在3组中的表达(×200) A: RENP组;B: ENP组;C: 对照组。 Fig. 3 Expression of NLRP3 inflammasome in three groups(×200) : RENP group; B: ENP group; C: Control group. |

|
图4 IL-1β在3组中的表达(×200) A: RENP组;B: ENP组;C: 对照组。 Fig. 4 Expression of IL-1β in three groups(×200) A: RENP group;B: ENP group;C: Control group. |
|
图5 IL-18在3组中的表达(×200) A: RENP组;B: ENP组;C: 对照组。 Fig. 5 Expression of IL-18 in three groups(×200) A: RENP group;B: ENP group;C: Control group. |
|
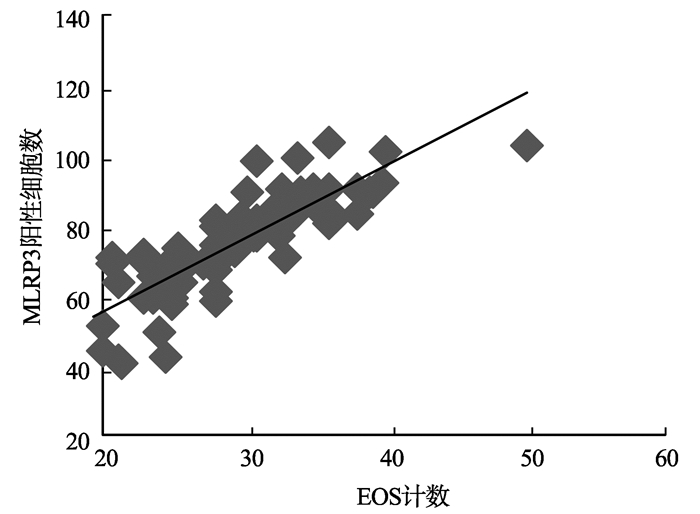
图6 ENP组织中NLRP3炎性小体阳性细胞数与EOS计数的相关性 Fig. 6 Correlation of positive NLRP3 inflammasome and EOS count in ENP tissue |
ENP组织中NLRP3炎性小体阳性细胞数与EOS计数正相关(r=0.82,P<0.01),见图 6;RENP组织中NLRP3炎性小体阳性细胞数与EOS计数亦呈正相关(r=0.72,P<0.01),见图 7。
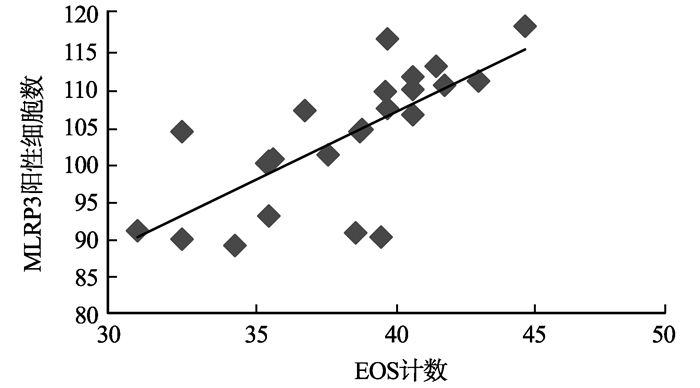
|
图7 RENP组织中NLRP3炎性小体阳性细胞数与EOS计数的相关性 Fig. 7 Correlation of positive NLRP3 inflammasome and EOS count in RENP tissue |
研究发现,鼻息肉术后复发率可高达24%~28%[9, 10],严重威胁人类健康。目前认为EOS及细胞因子在鼻息肉的发病中起着重要的作用。Stamberger在1988年首先提出了慢性嗜酸粒细胞性鼻-鼻窦炎的概念[11]。Newman等[8]发现,80%白种人鼻息肉为ENP[12],而国内鼻息肉患者中ENP约占50%。与NENP相比,ENP炎症反应更强,炎性细胞浸润更多,且手术及药物治疗疗效差,复发率更高。
固有免疫是机体防御的第一道防线,又称为非特异免疫,参与固有免疫的细胞包括吞噬细胞、树突状细胞以及上皮细胞等。其中吞噬细胞可以识别、吞噬病原体或识别多种炎症因子以促进炎症反应。吞噬细胞在识别病原体的过程中需要依赖通过模式识别受体(pattern recognition receptor,PRR)[13]。目前,已发现有3种PRR,分别为RIG-I样受体(RIG-I-like receptor,RLR)、Toll样受体(Toll-like receptor,TLR)和NLR。NLR可以活化胱天蛋白酶炎症体,即“NLRP3炎性小体”[6]。作为目前最明确的一个炎症体,NLRP3炎性小体可促进IL-1β、IL-18等前炎症细胞因子成熟。而IL-1β、IL-18都是重要的促炎因子,可通过结合相应受体激活炎性通路,与人类先天及后天的炎症性疾病密切相关。
NLRP3炎性小体可被多种不同内源性和外源性因素激活,常见的激活剂包括病毒、细菌、真菌及某些聚合物质。细胞中的三磷酸腺苷(adenosine triphosphate,ATP)和透明质酸等也可通过NLRP3炎性小体来激发炎症反应[14]。NLRP3炎性小体具体的激活机制目前尚不清楚。研究发现,NLRP3炎性小体与多种炎症性疾病相关。一种少见的自身炎症性疾病隐性蛋白-相关周期热综合征(cryopyrin-associated periodic syndrome,CAPS)[15],被认为由NLRP3炎性小体基因突变引起。此外,NLRP3炎性小体还参与了肠道炎性疾病。Zaki等[16]将小鼠NLRP3炎性小体成份中的NLRP3支架、ASC和caspase-1任何一部份敲除,小鼠结肠黏膜就会出现破坏增强,患结肠炎的易感性明显增加。Gauer等[17]发现,慢性肾脏炎症与NLRP3、IL-1β和IL-18等细胞因子有关。NLRP3炎性小体与呼吸道,尤其是下呼吸道慢性炎症性疾病密切相关。NLRP3、NLRP3产物及NLRP3激活物均可显著改变慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)的病理、生理过程,表明NLRP3炎性小体在COPD发生、发展过程中发挥重要作用。Hai等[18]通过检测哮喘小鼠动物模型及正常小鼠气道上皮NLRP3炎性小体、IL-1β、IL-18发现,哮喘小鼠气道上皮NLRP3、ASC、caspase-1、IL-1β、IL-18表达量明显增加。Mansson等[19]通过对24例鼻息肉组织进行研究发现,鼻息肉患者黏膜中NLR mRNA表达较非炎症鼻腔黏膜升高;患者进行局部糖皮质激素治疗后NLR表达降低。
本研究结果显示,IL-1β和IL-18在ENP组及RENP组的表达均高于对照组,但ENP组与RENP组比较无差异;NLRP3炎性小体在RENP组的表达明显高于ENP组和对照组,且其表达与EOS浸润呈正相关,表明NLRP3炎性小体、IL-1β、IL-18等促炎因子在ENP组织中高表达,均参与ENP发病。但IL-1β、IL-18在RENP组织中的表达并不显著高于原发ENP组织,NLRP3炎性小体却在RENP中出现了高表达,且其表达与EOS浸润程度呈正相关,说明NLRP3炎性小体参与ENP的复发,但具体机制尚不明确,还需进一步研究证实。
| [1] | Bteman N D, Fahy C, Woolford T J. Nasal polyps: still more questions than answers[J]. J Laryngol Otol, 2003, 117(1): 1-9. ( 1) 1) |
| [2] | Mygind N. Nasal Allergy[M]. 2nd edition. London: Blackwell Scientific Publications, 1979: 233-234.( 1) 1) |
| [3] | Ishitoya J, Sakuma Y, Tsukuda M. Eosinophilic chronic rhinosinusitis in Japan[J]. Allergol Int, 2010, 59(3): 239-245. ( 2) 2) |
| [4] | Ferguson B J. Categorization of eosinophilic chronic rhinosinusitis[J]. Curr Opin Otolaryngol Head Neck Surg, 2004, 12(3): 237-242. ( 1) 1) |
| [5] | Sun D I, Joo Y H, Kang J M. Clinical significance of eosinophilic cationic protein levels in nasal secretions of patients with nasal polyposis[J]. Eur Arch Otorhinolaryngol, 2009, 266(7): 981-986. ( 1) 1) |
| [6] | Martinon F, Burns K, Tschopp J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of pro-IL-beta[J]. Mol Cell, 2002, 10(2): 417-426. ( 2) 2) |
| [7] | 王金风, 刘晓菊, 曾晓丽.NLRP3炎性小体与肺部疾病[J].国际呼吸杂志, 2014,34(2): 115-118.( 1) 1) |
| [8] | Cao P P, Li H B, Wang B F, et al. Distinct immunopathologic characteristics of various types of chronic rhino sinusitis in adult Chinese[J]. J Allergy Clin Immunol, 2009, 124(3): 478-484. ( 2) 2) |
| [9] | Bachert C, Watelet J B, Gevaert P, et al. Pharmacological management of nasal polyposis[J]. Drugs, 2005, 65(11): 1537-1552. ( 1) 1) |
| [10] | Albu S, Tomescu E, Mexca Z, et al. Recurrence rates in endonasal surgery for polyposis[J]. Acta Otorhinolaryngol Belg, 2004, 58(1): 79-86. ( 1) 1) |
| [11] | Stamberger H. Diffuse eosinophil-dominated polyposis. FESS-endoscopic diagnosis and surgery of the paranasal sinuses and anterior skullbase[M]. Tuttlinge: Verlag Endo-Press, 1988: 41-44.( 1) 1) |
| [12] | Newman L J, Platts-Mills T A, Phillips D, et al. Chronic sinusitis: relationship of computed tomographic findings to allergy, asthma, and eosinophilia[J]. JAMA, 1994, 271(5): 363-367. ( 1) 1) |
| [13] | Medzliitov R, Janeway C J. Innate immune recognition: mechanisms and pathways[J]. Immunol Rev, 2000, 173: 89-97. ( 1) 1) |
| [14] | Yamasaki K, Muto J, Taylor K R, et al. NLRP3/cryopyrin is necessary for interleukin-1beta (IL-1beta) release in response to hyaluronan, an endogenous trigger of inflammation in response to injury[J]. J Biol Chem, 2009, 284(19): 12762-12771.( 1) 1) |
| [15] | Feldmann J, Prieur A M, Quartier P, et al. Chronic inflatile neurological cutaneous and articular syndrome is caused by mutations in CIAS1, a gene highly expressed in polymorphonuclear cells and chondrocytes[J]. Am J Hum Genet, 2002, 71(1): 198-203.( 1) 1) |
| [16] | Zaki M H, Boyd K L, Vogel P, et al. The NLRP3 inflammasome protects against loss of epithelial integrity and mortality during experimental colitis[J]. Immunity, 2010, 32(3): 379-391.( 1) 1) |
| [17] | Gauer S, Sichler O, Obermuller N, et al. IL-18 is expressed in the intercalated cell of human kidney[J]. Kidney Int, 2007, 72(9): 1081-1087.( 1) 1) |
| [18] | Besnard A G, Guillou N, Tschopp J, et al. NLRP3 inflammasome is required in murine asthma in the absence of aluminum adjuvant[J]. Allergy, 2011, 187(7): 1047-1057.( 1) 1) |
| [19] | M nsson A, Bogefors J, Cervin A, et al. NOD-like receptors in the human upper airways: a potential role in nasal polyposis[J]. Allergy, 2011, 66(5): 621-628.( 1) 1) |
 2016, Vol. 30
2016, Vol. 30

