2. 泰山医学院附属聊城市第二人民医院检验科, 山东 临清 252600;
3. 山东大学齐鲁医院耳鼻咽喉科, 山东 济南 250012
2. Department of Clinical Laboratory, The Second Peoples Hospital of Liaocheng, Affiliated Hospital of Taishan Medical College, Linqing 252600, Shandong, China;
3. Department of Otolaryngology, Qilu Hospitai of Shandong University, Jinan 250012, Shandong, China
细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)是丝、苏氨酸蛋白激酶的一种,可用来传递丝裂原信号[1],该酶存在于正常细胞的胞浆中,当被引物激活后传递至细胞核,参与细胞的减数分裂、有丝分裂等一系列生理过程,调节转录因子的活性,产生细胞效应[2]。近些年研究,细胞外信号调节激酶5(ERK5)是最新发现的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族中的一个重要的一级激酶,在心血管系统疾病、神经系统疾病、肿瘤治疗等方面作用逐渐在临床上被重视,是MAPK通路之一[3],在细胞增殖、肿瘤转移恶化、血管增生等方面呈高水平表达。鼻息肉患者鼻腔和鼻窦黏膜内细胞水肿,在鼻道内可形成单发和多发的息肉组织[4],有文献指出,息肉组织持续性增生状态与ERK5存在一定的关系。本研究主要探讨ERK5在鼻息肉细胞中的表达和意义,旨在为了解鼻息肉发生机制,为鼻息肉的诊断和治疗提供客观依据。
1 资料与方法 1.1 研究对象根据我国2012年昆明慢性鼻-鼻窦炎(chronic rhinitis sinusitis,CRS)诊疗标准[5],将CRS分为伴鼻息肉(chronic rhinosinusitis with nasal polyps,CRSwNP)或不伴鼻息肉(chronic rhinosinusitis without nasal polyps,CRSsNP)两种亚型。分析2013年1月至2014年12月在聊城市第二人民医院耳鼻咽喉科手术治疗72例CRS患者的临床资料。术前根据患者的临床症状、体征、鼻内镜检查及鼻窦CT影像学资料进行诊断。选取其中37例CRSwNP患者为实验组(CRSwNP组),男24例,女13例,(41.72±11.06)岁。选取35例CRSsNP患者作为对照组(CRSsNP组),其中男19例,女16例,(38.43±9.37)岁。所有研究对象自愿参加此项研究,遵守研究规定,了解并遵守治疗流程,自愿签署书面知情同意书。两组研究对象在其他临床资料水平比较上差异无统计学意义(P>0.05)。
1.2 检测方法抽取两组研究对象清晨静脉血3 mL,离心后置于-20 ℃环境下保存。采用酶联免疫试验(ELISA)试剂盒测定血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素5(Interleukin-5,IL-5)和白细胞介素8(Interleukin-8,IL-8)水平。
将CRSwNP组息肉组织(均已经病理证实)和CRSsNP组采集的取自窦口鼻道复合体黏膜进行裂解,充分裂解后离心5 min取上层清液。提取细胞总蛋白,采用改良Lowery法测定蛋白浓度。取上层清液进行电泳,结束后转膜,加入ERK5单克隆抗体在4 ℃摇床上孵育过夜,使用缓冲液进行冲洗,加入驴抗山羊单克隆IgG抗体,室温孵育2 h后加入ECL显色试剂放射显影[6]。
1.3 统计学处理采用SPSS 19.0软件,计量资料以$\overline x \pm s$表示,行t检验;计数资料采用χ2检验。采用Pearson相关性检验分析鼻息肉组患者ERK5表达与TNF-α、IL-8相关性。检验水准取α=0.05,P<0.05为差异有统计学意义。
2 结 果 2.1 一般资料比较本研究共选入研究对象72例,其中CRSwNP组37例,CRSsNP组35例。两组患者一般资料详细情况见表 1。比较两组受试者的性别比例、年龄、体质量指数(BMI)、吸烟及饮酒史,差异均无统计学意义(P>0.05)。
| 表1 两组研究对象一般临床资料比较 Tab. 1 Comparison of clinical data between the two groups |
CRSwNP组患者血清中TNF-α(t=16.7,P<0.001)、IL-5(t=13.81,P<0.001)和IL-8(t=8.642,P<0.001)含量显著高于对照组。
| 表2 两组研究对象血清中TNF-α、IL-5和IL-8含量比较($\overline x \pm s$) Tab. 2 Comparison of serum TNF-α、IL-5 and IL-8 level between the two groups($\overline x \pm s$) |
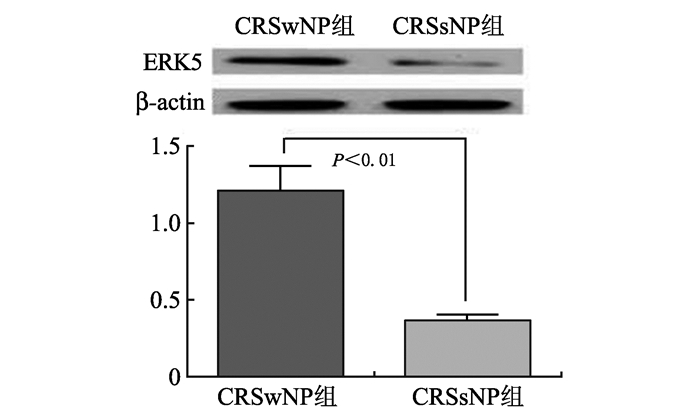
经Western Boltting检测发现,CRSwNP组中ERK5蛋白表达水平显著高于CRSsNP组(灰度比1.21±0.16 vs 0.36±0.04,P<0.01),见图 1。
|
图1 两组研究对象细胞ERK5蛋白表达情况 Fig. 1 Exprssion of ERK5 protein in the two groups |
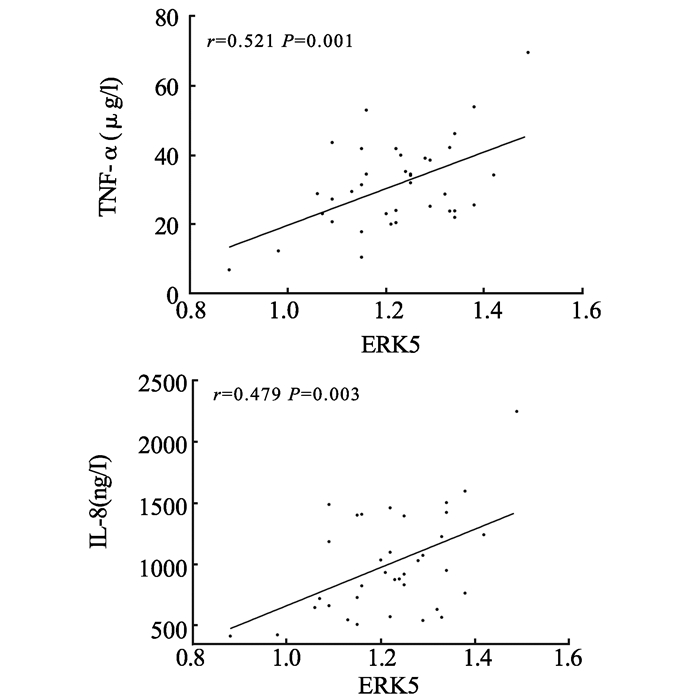
采用Pearson相关性检验分析CRSwNP组患者ERK5蛋白表达与TNF-α、IL-8相关性,结果发现,CRSwNP组患者ERK5蛋白表达与TNF-α(r=0.521,P=0.001)及IL-8(r=0.479,P=0.003)呈显著正相关,见图 2。
|
图2 CRSwNP组患者ERK5蛋白表达与TNF-α、IL-8相关性分析 Fig. 2 Correlation between the expression of ERK5 protein and TNF-α and IL-8 level in patients of CRSwNP group |
鼻息肉是多种因素所致的鼻黏膜慢性炎性病变,发病机制尚未完全明确,主要与鼻部纤毛形态结构和功能障碍、微环境变化影响、嗜酸性粒细胞的作用和细胞因子的作用有关[7]。鼻部黏膜纤毛结构异常,黏液物理特性发生异常,使得纤毛功能发生障碍,外界细菌大量进入鼻腔,在鼻腔内大量积聚,使鼻部和下呼吸道反复感染,容易诱发息肉的产生[8]。中鼻道附近、钩突或筛泡表面及半月裂狭窄或局部黏膜肿胀,导致纤毛活动受限为息肉的产生创造了条件[9]。产生息肉的组织间常常有大量的嗜酸性细胞浸润,发生细胞毒作用,损伤鼻部上皮细胞和组织。息肉发生时黏膜上皮血管通透性增高、组织水肿、上皮细胞破裂、细胞外基质大量增生、血管及腺体膨胀,逐渐形成息肉[10]。广义而言,炎症是一种机体对感染和损伤的自我保护机制,而炎性细胞的长期浸润,且不断释放的炎性介质和细胞因子(如TNF-α、IL-5、IL-8等)相互作用,促进鼻黏膜局部炎症反应不断循环扩大。
本研究结果发现,CRSwNP组患者血清中TNF-α、IL-5和IL-8含量显著高于对照组,表明鼻息肉的产生是一种多种细胞因子参与的I型变态反应,TNF-α可以促进T淋巴细胞MHC I类抗原表达,增强胸腺细胞、T细胞增殖能力和IgA的分泌产生。TNF-α可以抑制病毒复制、阻碍病毒蛋白的合成、降低病毒的感染性,从而杀伤病毒细胞。IL-5可以促进B淋巴细胞的增殖和分化,诱导嗜酸性粒细胞的产生,诱导细胞毒T细胞的生成,促进分泌型IgA的生成。IL-8是由单核-巨噬细胞生成,激活中性粒细胞,中性粒细胞与IL-8结合后形状发生改变,特异性地释放若干活性产物,诱导机体局部炎症反应,杀灭侵入的细菌,损伤炎症周围细胞。Western-Boltting检测结果发现,在CRSwNP组中ERK5表达水平显著高于正常组,说明息肉组织增生与周围血管生成与ERK5通路激活有关。ERK5表达与TNF-α及IL-8呈现显著正相关,TNF-α可通过激活ERK1/2、ERK5、P-38、C-JNK等MAPK链的四个亚族,加速细胞外基质降解及黏膜上皮细胞的损伤。ERK5通路可在氧化作用下被激活,诱导细胞增殖,TNF-α等炎症因子高表达,可激活ERK5信号传导途径促进IL-6、IL-8等炎症因子的生成[11]。
综上所述,ERK5在CRSwNP患者中高水平表达,且与TNF-α及IL-8呈显著正相关关系。
| [1] | Miranda M, Rozali E, Khanna K K, et al. MEK5-ERK5 pathway associates with poor survival of breast cancer patients after systemic treatments[J]. Oncoscience, 2015, 2(2):99-101.( 1) 1) |
| [2] | Finegan K G, Perez-Madrigal D, Hitchin J R, et al. ERK5 is a critical mediator of inflammation-driven cancer[J]. Cancer Res, 2015, 75(4):742-753.( 1) 1) |
| [3] | 尹宏, 黄欣, 王海燕, 等. ERK5在胃腺癌组织中的表达及临床意义[J]. 中国现代医学杂志, 2014, 24(20):56-60.YIN Hong, HUANG Xin, WANG Haiyan, et al. Expression of ERK5 in gastric adenocarcinoma and its clinical significance[J]. Chin J Mod Med, 2014, 24(20):56-60.( 1) 1) |
| [4] | Yue B, Ren Q X, Su T, et al. ERK5 silencing inhibits invasion of human osteosarcoma cell via modulating the Slug/MMP-9 pathway[J]. Eur Rev Med Pharmacol Sci, 2014, 18(18):2640-2647.( 1) 1) |
| [5] | 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组, 中华医学会耳鼻咽喉头颈外科学分会鼻科学组. 慢性鼻-鼻窦炎诊断和治疗指南(2012, 昆明)[J]. 中华耳鼻咽喉头颈外科杂志, 2013, 48(2):92-94.( 1) 1) |
| [6] | 王耀晟, 程晓曙, 洪葵, 等. 细胞外信号调节蛋白激酶5/凋亡调节蛋白信号途径在低温诱导心肌细胞损伤及凋亡中的调控作用[J]. 中国循环杂志, 2014(7):540-544.WANG Yaosheng, CHENG Xiaoshu, HONG Kui, et al. The regulative role of ERK5/Bim pathway in hypothermal stimulation induced neonatal rat's cardiomyocytes injury and apoptosis[J]. Chin Circ J, 2014(7):540-544.( 1) 1) |
| [7] | Xiu Q, Meng C, Li L, et al. Allergic factors affect on severity of chronic rhinosinusitis and postoperative outcomes[J]. Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2015, 29(1):34-38, 44.( 1) 1) |
| [8] | Koseoglu S, Ozcan K M, Ikinciogullari A, et al. Evaluation of autoinflammatory disease genes in nasal polyposis[J]. Turk J Med Sci, 2015, 45(1):136-140.( 1) 1) |
| [9] | Wang C, Lou H, Wang X, et al. Effect of budesonide transnasal nebulization in patients with eosinophilic chronic rhinosinusitis with nasal polyps[J]. J Allergy Clin Immunol, 2015, 135(4):922-929.e6.( 1) 1) |
| [10] | Poposki J A, Peterson S, Welch K, et al. Elevated presence of myeloid dendritic cells in nasal polyps of patients with chronic rhinosinusitis[J]. Clin Exp Allergy, 2015, 45(2):384-393.( 1) 1) |
| [11] | Heo K S, Cushman H J, Akaike M, et al. ERK5 activation in macrophages promotes efferocytosis and inhibits atherosclerosis[J]. Circulation, 2014, 130(2):180-191.( 1) 1) |
 2016, Vol. 30
2016, Vol. 30
