鼻息肉是耳鼻咽喉-头颈外科的常见病和多发病,是鼻腔及鼻窦黏膜慢性炎性病变。研究表明,鼻息肉的发病与多种因素有关,如变态反应、炎症、感染、损伤、遗传等因素,其中变态反应是最为重要的因素之一[1, 2, 3, 4, 5, 6, 7, 8],但其确切发病机制尚不清楚。本研究在前期应用基因芯片技术研究鼻息肉发病机制的基础上[9, 10],利用蛋白质组学技术研究正常鼻黏膜组织与鼻息肉组织之间的差异表达蛋白,并分析差异表达蛋白的功能,从而探索鼻息肉的发病机制。
1 材料与方法 1.1 实验材料本实验标本取自上海长征医院耳鼻咽喉头颈外科2013年1月至2014年12月收治的4例鼻息肉患者,均通过前鼻镜检查、鼻内镜检查及鼻窦CT扫描确诊。患者均为男性,30~65岁,平均(41±3.12)岁。取得标本前均得到患者本人同意并签署知情同意书。排除有哮喘史及阿司匹林过敏史、皮肤过敏原试验阳性,及术前2周使用抗生素及类固醇激素者。术中分别取4例患者的中鼻道正常鼻黏膜组织及鼻息肉组织,迅速于生理盐水下冲洗,去除血液及碎骨片,PBS缓冲液冲洗后,以锡箔纸包裹严密,置于塑料冻存管内,-80 ℃冰箱保存待测。实验中所用的主要试剂包括:SDS、DTT、Tris、色氨酸、过硫酸铵、溴酚蓝、甘油、乙醇、TEAB等。
1.2 实验方法 1.2.1 样品裂解和蛋白质定量标本样品解冻后进行裂解蛋白质样品定量。将色氨酸标准品和蛋白质样品稀释后检测色氨酸荧光强度,计算样品中的色氨酸浓度。样品中蛋白质浓度=色氨酸浓度/1.3%。然后行单向十二烷基硫酸钠聚丙烯酰胺凝胶(1D-SDS-PAGE)电泳和胶图银染。
1.2.2 蛋白质酶解100 μg样品离心,12 000 g离心约50 min,弃滤液。加入200 μL UA buffer,12 000 g离心50 min,弃滤液。加入终浓度为50 mM的泌吲哚乙酸(IAA),避光室温反应20 min,12 000 g离心30 min,弃滤液。加入200 μL UA buffer,12 000 g离心30 min,弃滤液。加入200 μL 50 mM的四乙基溴化铵(TEAB),12 000 g离心40 min,弃滤液。重复2遍。加入2 μg 质谱测序级胰酶(Promega,V5113),37 ℃酶解过夜。12 000 g离心20 min收集滤出液,冷冻干燥。
1.2.3 同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAO)及SCX强阳离子肽段分级iTRAQ 8plex 试剂放置于室温中,使用50 μL异丙醇溶解后加入到各个样品中,室温下以300 r/min的速度振荡反应2 h,再向各管加入50 μL去离子水,室温下以300 rpm的速度振荡反应30 min,终止标记反应。合并各个样品,充分振荡混匀后分装,20 μg/管,真空冷冻干燥保存。
1.2.4 LC-MS/MS质谱鉴定C18反相毛细管色谱柱直径 75 μm、长15 cm,流速为250 nL/min,全程分析时间为240 min/馏分。肽段洗脱梯度为流动相 B(含 0.1%甲酸的乙腈)在208 min内从6%增加至20%,208 min至228 min内从20%增加至35%,其后2 min内升至90%并维持至240 min。
1.2.5 数据库搜索和定量信息提取质谱产生的原始文件采用Proteome Discoverer进行数据库搜索,产生的结果用Proteomics Tool Suite进行谱图筛选,校正同位素标签纯度,定量数据整合。
1.3 统计学处理采用IBM SPSS Statistics 20.0软件,差异蛋白筛选标准是fold<0.83或fold>1.2,筛选时行t-test检验,检验水准取α=0.05,P<0.05为差异有统计学意义。
2 结 果 2.1 蛋白质抽提产物1D-SDS-PAGE电泳结果各个样品的蛋白质抽提产物SDS-PAGE总体分布模式在相同的样品分组中比较类似,蛋白质电泳行为正常,降解现象不明显,蛋白质定量比较一致,符合后续实验研究分析的要求。见图 1。

|
图1 蛋白质抽提产物1D-SDS-PAGE电泳结果 Fig. 1 SDS-PAGE electrophoresis of surface proteins |
控制肽段和蛋白质假阳性率小于0.01,共得到14 694条非冗余肽段,对应于2 463个蛋白质组group,在8个iTRAQ定量通道中均存在定量信息,且所有通道内蛋白分子量Log2对数值的上四分位数、中位数、下四分位数基本保持在同一水平。见图 2。未经校正的原始数据总体分布差异较小。上述结果显示本实验iTRAQ定量标记具有严格的质量控制和优秀的质谱定量能力。
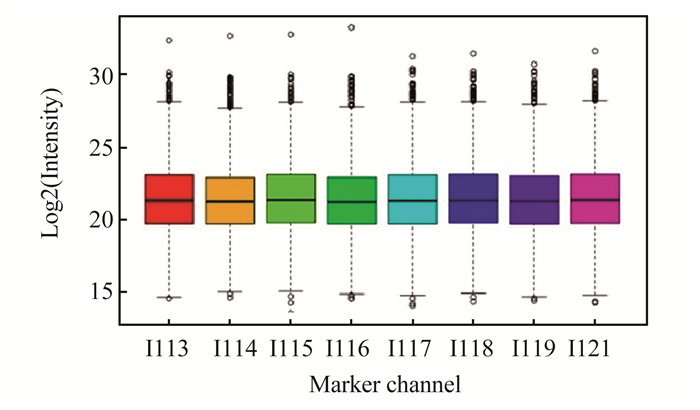
|
图2 iTRAQ原始定量结果箱线图分布 Fig. 2 Box figure of original quantitative results by iTRAQ |
进一步分析各样品的蛋白质定量频率分布,结果显示各通道蛋白分子量-蛋白密度曲线基本重合,峰值集中在20~23之间,提示本实验具有良好的数据重复性和定量精确性。见图 3。
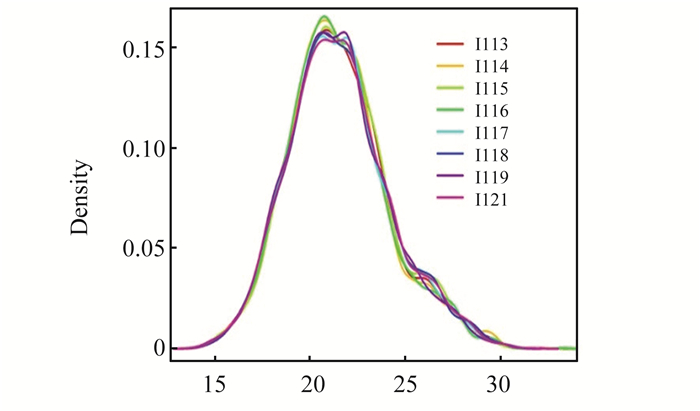
|
图3 蛋白质定量频率分布 Fig. 3 Quantitative frequency distribution |
分析各个实验处理组原始数据的两两相关性,R2值为0.97~1,提示数据具有良好的相关性,表明本实验iTRAQ定量结果数据具有良好的重复性和可信度。见图 4。

|
图4 数据两两相关性分析 Fig. 4 Pair-wise correlation analysis |
鼻息肉组与正常鼻黏膜组织比较,共筛选出差异表达蛋白311个。上调蛋白88个,主要包括CLC、PLEKHA7等,其中上调2倍以上的蛋白18个,见表 1;下调蛋白223个,主要包括S100A1等,其中下调50%以上的蛋白65个,见表 2。
| 表1 部分上调蛋白 Tab.1 List of some up-regulated proteins |
| 表2 部分下调蛋白 Tab. 2 List of some down-regulated proteins |
鼻息肉的发病机制尚未完全阐明,现较公认的观点认为变态反应是其重要发病机制之一。作者前期应用基因芯片技术探讨鼻息肉的发病机制,结果提示细胞因子、炎症反应等对鼻息肉的发生可能起重要作用[9, 10]。本实验在此基础上利用蛋白质组学的方法,检测正常成年人中鼻道鼻腔黏膜与鼻息肉组织中的蛋白表达谱,结果发现大量差异表达蛋白。
3.1 CLC溶血磷脂酶广泛存在于原核细胞和真核细胞中,被认为与磷脂代谢密切相关,在嗜酸性粒细胞内蛋白中占有很大比例[11, 12]。颗粒内超微结构分析表明,CLC蛋白主要与炎症反应有关[13],主要生物学功能是将溶血卵磷脂水解为甘油磷脂酰胆碱以及少量游离脂肪酸。溶血磷脂是细胞骨架的重要组成部分,因此溶血磷脂酶在维持细胞骨架稳定性方面具有重要作用。本实验中多组比较发现,CLC均有大幅度上调,这与Ghafouri等[14]对行鼻腔冲洗的变应性鼻炎患者进行的蛋白质组学研究结果一致。同时,Bryborn等[15]也据此进行了基因验证,证实CLC的遗传变异与变应性鼻炎相关。我们推测CLC参与鼻息肉发病的可能机制是细胞骨架破坏引起细胞坏死或凋亡,释放一系列细胞因子,触发或进一步加重了鼻腔黏膜局部的变态免疫反应,导致鼻息肉的发生。
3.2 PLEKHA7PLEKHA7是一种附着链接蛋白,对维持黏膜上皮细胞稳定性具有重要作用,与上皮细胞之间的紧密链接结构特别是黏附链接有关[16, 17],为黏附小带的生发和形态、功能维持所必需,尤其在胚胎发育期,参与上皮细胞之间的空间结构、排列方式等[19],在黏附链接自发性的形成-分解平衡稳态中发挥重要作用[18]。PLEKHA7主要与闭角型青光眼有关[20],目前关于其与变应性鼻炎或鼻息肉之间的关系尚无报道。本实验检测出PLEKHA7在多组鼻息肉组织中表达均明显上调,推测可能在鼻黏膜上皮损伤后的修复中,其参与了上皮重建,促进了鼻息肉的发生发展。
3.3 与前期研究结果对比我们将本次研究结果与前期基因芯片研究结果[9, 10]对比,发现S100蛋白的不同亚型表达情况不同。基因芯片研究结果显示S100A2表达上调,而本次蛋白质组学研究中,S100A1表达明显下调。
S100A1属于S100大家族中的一员,为钙结合蛋白,主要生物学功能是调节细胞内外的钙离子浓度,从而影响蛋白磷酸化,最终实现对细胞膜上的离子通道及电生理过程的调控。以往研究认为,S100蛋白主要与肿瘤的发生发展密切相关。Richer等[21]研究发现,S100A7和 S100A8在鼻息肉组织中较正常对照明显下调;而Tieu等[22]也发现鼻息肉组织中S100蛋白表达下调,并通过进一步免疫组化染色发现,蛋白下调主要发生于黏膜上皮层。王鑫等[23]在研究鼻息肉免疫相关基因表达谱时发现,鼻息肉组织中S100A2表达上调。本实验中,S100A1在多组鼻息肉组织中均显著下调,与前期基因芯片研究结果及王鑫等人的结果不同,提示S100钙结合蛋白与鼻息肉的发生发展密切联系,而不同的亚型也可能发挥着不同的作用。
本实验首次将iTRAQ这一新的分子生物学技术运用于鼻息肉的蛋白质组学研究中,对探索鼻息肉的发病机制有重要意义。实验结果发现,鼻息肉及正常鼻黏膜之间有大量差异表达蛋白,其中CLC、PLEKHA7、S100A1等蛋白在其他蛋白质组学研究中尚未见报道,作为新的关键蛋白为鼻息肉的病因学研究开辟可能的新方向,但这些关键蛋白在鼻息肉发病过程中如何发挥作用有待于进一步研究。
| [1] | 韩德民. 耳鼻咽喉头颈外科学[M]. 北京: 北京大学医学出版社, 2004:229.( 1) 1) |
| [2] | Gmssman J. One airway, one disease[J]. Chest, 1997, 111(Suppl 2):111-16.( 1) 1) |
| [3] | Kim H J, Lee K, Yoo J B, et al. Bacteriological findings and antimicrobial susceptibility in chronic sinusitis with nasal polyp[J]. Acta Otolaryngol, 2006, 126(5):489-497.( 1) 1) |
| [4] | Mygind N, Dahl R, Bachert C. Nasal polyposis, eosinophil dominated inflammation, and allergy[J].Thorax, 2000, 55(Suppl2):S79-S83.( 1) 1) |
| [5] | Norlander T, Fudami M, Wetrin K M. Formation of mucosal polyps in the nasaI and maxillary sinus cavities by infection[J]. Otolaryngol Head Neck Surg, 1993, 109(9):552-529.( 1) 1) |
| [6] | Norlander T, Westrm K M, Fukami M. Experimentally induced polyps in the sinus mucosa: a structural analysis of the initial stages[J]. Laryngoscope, l996, 106(2 Pt 1):196-203.( 1) 1) |
| [7] | Greisner W A, Senipane G A. Hereditary factor for nasal polyps[J]. Allergy Asthma Proc, 1996, 17(5):283-286.( 1) 1) |
| [8] | Stolbová D. Hereditary component in the etiology of nasal polyps[J]. Cesk Otolaryngol, 1982, 31(4):211-217.( 1) 1) |
| [9] | Wu Jian, Liu Bing, He Jin, et al. Gene expression profiles of nasal polyps associated with allergic rhinitis[J]. Am J Otolaryngol, 2009, 30(1):24-32.( 3) 3) |
| [10] | Liu Bing, Wu Jian, Fan Jingping, et al. Gene expression profiles in human nasal polyps studied by DNA microarray[J]. Clin Otorhinolaryngol Head Neck Surg(Chin), 2008, 22(11):495-497.( 3) 3) |
| [11] | Ackerman S J, Weil G J, Gleich G J. Formation of Charcot-Leyden crystals by human basophils[J]. J Exp Med, 1982, 155(6):1597-609.( 1) 1) |
| [12] | Ackerman S J, Loegering D A, Gleich G J. The human eosinophil Charcot-Leyden crystal protein: biochemical characteristics and measurement by radioimmunoassay[J]. J Immunol, 1980, 125(5):2118-2126.( 1) 1) |
| [13] | Dvorak A M, Ackerman S J. Ultrastructural localization of the Charcot-Leyden crystal protein (lysophospholipase) to granules and intragranular crystals in mature human basophils[J]. Lab Invest, 1989, 60(4):557-567.( 1) 1) |
| [14] | Ghafouri B, Irander K, Lindbom J, et al. Comparative proteomics of nasal fluid in seasonal allergic rhinitis[J]. J Proteome Res, 2006, 5(2):330-338.( 1) 1) |
| [15] | Bryborn M, Halldén C, Säll T, et al. CLC-a novel susceptibility gene for allergic rhinitis?[J]. Allergy, 2010, 65(2):220-228.( 1) 1) |
| [16] | Pulimeno P, Paschoud S, Citi S. A role for ZO-1 and PLEKHA7 in recruiting paracingulin to tight and adherens junctions of epithelial cells[J]. J Biol Chem, 2011, 286(19):16743-16750.( 1) 1) |
| [17] | Kurita S, Yamada T, Rikitsu E, et al. Binding between the junctional proteins afadin and PLEKHA7 and implication in the formation of adherens junction in epithelial cells[J]. J Biol Chem, 2013, 288(41):29356-29368.( 1) 1) |
| [18] | Hong S, Troyanovsky R B, Troyanovsky S M. Spontaneous assembly and active disassembly balance adherens junction homeostasis[J]. Proc Natl Acad Sci USA, 2010, 107(8):3528-3533.( 1) 1) |
| [19] | Nishimura T, Takeichi M. Remodeling of the adherens junctions during morphogenesis[J]. Curr Top Dev Biol, 2009, 89(1):33-54.( 1) 1) |
| [20] | Chen Y, Chen X, Wang L, et al. Extended association study of PLEKHA7 and COL11A1 with primary angle closure glaucoma in a Han Chinese population[J]. Invest Ophthalmol Vis Sci, 2014, 55(6):3797-3802.( 1) 1) |
| [21] | Richer S L, Truong-Tran A Q, Conley D B, et al. Epithelial genes in chronic rhinosinusitis with and without nasal polyps[J]. Am J Rhinol, 2008, 22(3):228-234.( 1) 1) |
| [22] | Tieu D D, Peters A T, Carter R G, et al. Evidence for diminished levels of epithelial psoriasin and calprotectin in chronic rhinosinusitis[J]. J Allergy Clin Immunol, 2010, 125(3):667-675.( 1) 1) |
| [23] | Wang Xin, Dong Zhen. Eexpression profile of immune associated genes in nasal polyps[J]. Chin J Otorhinolaryngol, 2004, 39(12):721-724.( 1) 1) |
 2016, Vol. 30
2016, Vol. 30

