变应性鼻炎(allergic rhinitis,AR)是临床上常见的、严重影响患者生活质量的鼻黏膜慢性炎症性疾病,在世界范围内呈流行增加趋势,影响了全球近40%的人口[1]。目前认为,AR是特应性个体接触致敏原后产生的由IgE介导且有多种免疫细胞及细胞因子参与的Ⅰ型变态反应疾病,以鼻痒、鼻塞、清水样涕、发作性喷嚏为主要临床表现。关于AR的治疗,目前普遍认为变应原特异性免疫治疗(简称免疫治疗)是惟一可改变疾病自然进程的对因疗法,常用的途径是皮下免疫治疗(subcutaneous immunotherapy,SCIT)和舌下免疫治疗(sublingual immunotherapy,SLIT)[2-3]。免疫治疗适用于AR患者存在与临床症状相关的变应原特异性IgE(specific IgE,sIgE)抗体增高[4],但在临床应用中发现并非所有患者均可取得满意疗效,故筛选出可以预判或评价治疗效果的客观指标显得尤为重要。然而,国内外多个诊疗指南(共识)均指出目前尚缺乏可常规用于免疫治疗患者筛选及疗效预判的生物标志物[4-8]。本研究通过对AR患者接受免疫治疗的随访资料进行分析,观察免疫治疗的效果与治疗前的基线血清IgE水平是否存在关联,从而探讨免疫治疗的疗效预测指标。
1 资料与方法 1.1 研究对象将2012至2014年来我院耳鼻咽喉科就诊并接受免疫治疗的中-重度持续性AR患者,结合患者来院治疗的便利程度及主观意愿分为SCIL组和SLIT组,将完成免疫治疗1年的病例作为研究对象。AR患者的诊断符合“变应性鼻炎诊断和治疗指南(2009年,武夷山) ”[9],纳入前常规行变应原皮肤点刺试验(skin prick test,SPT)和/或血清sIgE抗体检测,以明确变应原类型。SPT采用常见吸入物变应原标准化试剂(德国阿罗格公司产品),组胺作阳性对照,生理盐水作阴性对照。采用酶联免疫捕获法(苏州浩欧博生物医药有限公司产品)测定血清总IgE(total IgE,tIgE)和slgE,sIgE评定标准为:0级(<0.35 IU/mL),1级(0.35~0.69 IU/mL),2级(0.7~3.4 IU/mL),3级(3.5~17.4 IU/mL),4级(17.5~49.9 IU/mL),5级(50~100 IU/mL),6级(>100 IU/mL)。所有患者对屋尘螨(Dermatophagoides pteronyssinus,Dp)和/或粉尘螨(Dermatophagoidess farinae,Df)呈阳性反应,即SPT≥++和/或slgE≥2级,且患者的临床症状与尘螨致敏具有相关性。纳入病例均排除患有鼻窦炎、鼻息肉、支气管哮喘及阿司匹林耐受不良等其他常见呼吸道疾病。免疫治疗前4周内未使用过糖皮质激素,2周内未使用过抗组胺药和白三烯受体拮抗剂等抗过敏药物。
1.2 治疗方案SCIT组使用标准化屋尘螨变应原制剂(安脱达,丹麦ALK公司产品),在上臂远端1/3处行皮下注射,分两个阶段进行:起始阶段(剂量递增期)和维持阶段(剂量维持期)。起始阶段每周注射1次,剂量从20 SQ-U开始,按照以下方案递增:20、40、80、200、400、800、2 000、4 000、8 000、10 000、20 000、40 000、60 000、80 000、100 000 SQ-U,共计15周;间隔1周后,维持阶段从第17周开始,采用维持剂量100 000 SQ-U注射1次(1 mL),隔4周再注射1次,随后每6周注射1次,直至疗程结束。每次注射后,患者在医院至少观察30 min,确认安全后方可离开。
SLIT组使用舌下含服粉尘螨滴剂1~5号(畅迪,浙江我武生物科技有限公司产品)。将粉尘螨滴剂滴于舌下,含2~3 min后吞咽,每日固定时间(夜间睡前)用药,14岁及以下儿童依次按1、2、3、4号使用,14岁以上患者则依次按1、2、3、4、5号使用。前1~3周为剂量递增期:即1~3号(蛋白浓度分别为1、10、100 μg/mL)舌下含服,1次/d,每周7 d剂量依次为1、2、3、4、6、8、10滴;4~5周含服4号(蛋白浓度为333 μg/mL)3滴,1次/d。14岁及以下儿童的维持剂量为含服4号,每次3滴,1次/d;14岁以上患者的维持剂量为含服5号(蛋白浓度为1 000 μg/mL),每次2滴,1次/d。
两组患者在治疗期间如AR症状加重,可适当调整剂量,并允许短期对症应用口服抗组胺药和/或鼻内糖皮质激素等抗过敏药物。
1.3 观察指标两组患者均定期随访,主要包括电话随访及门诊随访,由专门的医护人员对患者进行治疗指导及提供咨询、解答患者疑问。当免疫治疗满1年时嘱患者来院复查血清tIgE和sIgE(Dp-sIgE及Df-sIgE)。同时询问并记录患者对治疗效果的主观评价(patient-reported outcomes)[10],根据治疗1年后相对于治疗之前的主观感受,分为显效、有效、无效及恶化4种结果,所采用的评价标准为:① 显效:维持阶段症状消失;② 有效:维持阶段症状显著改善;③ 无效:维持阶段症状无明显改善,仍需经常使用抗过敏药物缓解症状;④ 恶化:治疗1年后较治疗前症状反而加重。按照显效+有效例数计算总有效率。对于认为免疫治疗有效的患者(显效+有效病例)记录其在鼻塞、流涕、鼻痒和喷嚏等4个主要症状中,改善最明显的症状;对于认为免疫治疗无效果的患者(无效+恶化病例),记录其困扰最明显的症状。
比较免疫治疗1年后患者血清tIgE、Dp-sIgE和Df-sIgE水平的变化。分别计算SCIT组及SLIT组的总有效率,并依据治疗有效与否对血清IgE抗体水平的变化进行分层分析。使用受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)对免疫治疗前患者的基线血清IgE抗体水平与治疗效果的关系进行分析,以期获得具有最佳预测效果的血清指标及其最佳临界值(cut-off值)。
1.4 统计学处理使用SPSS 19.0软件,对符合正态分布的数值型变量采用x±s表示,对不符合正态分布的数值资料采用对数转换为符合正态分布的数据资料。免疫治疗前后患者血清抗体水平的变化采用配对样本t检验,计量资料的分布比较采用Fisher确切概率法χ2检验。依据ROC曲线下面积(area under curve,AUC)最大法确定具有最佳预测效果的血清指标,使用约登指数(Youden's index)法确定ROC曲线上最佳cut-off值。双侧P<0.05被认为差异有统计学意义。
2 结 果 2.1 基本情况截至2015年10月,SCIT组50例完成1年的治疗及随访,年龄6~51(20.66±12.03)岁,其中男29例,女21例;SLIT组58例完成1年的治疗及随访,年龄4~53(19.33±12.85)岁,其中男37例,女21例。其中,SCIT组Dp和Df均呈阳性48例,单一Df阳性2例;SLIT组Dp和Df均呈阳性55例,单一Df或Dp阳性分别为2例和1例。两组患者年龄、性别及尘螨致敏情况的差异无统计学意义(P>0.05),具有可比性。在免疫治疗过程中,所有患者耐受性良好,仅3例(2.78%)出现轻度不良反应(口麻、局部瘙痒等),经剂量调整或未作特殊处理即自行消失,均未见严重的全身不良反应发生。
2.2 治疗效果SCIT组治疗1年后的主观疗效评价见表 1,两种疗法的治疗结果差异无统计学意义(χ2=2.625,P=0.479)。
| 表 1 SCIT组和SLIT组患者治疗1年后的主观疗效评价[n(%)] Table 1 Patient-reported outcomes in the SCIT and SLIT groups after 1 year treatment[n(%)] |
在免疫治疗有效果(显效+有效)的70例患者中,改善最明显的症状依次为喷嚏(40例,57.1%)、流涕(18例,25.8%)、鼻塞(6例,8.6%)及鼻痒(6例,8.6%)。在免疫治疗无效果(无效+恶化)的38例患者中,最困扰的症状依次为喷嚏(21例,55.3%)、流涕(7例,18.4%)、鼻塞(7例,18.4%)及鼻痒(3例,7.9%)。
2.3 血清IgE抗体水平的变化经正态性检验,血清IgE抗体(tIgE、Dp-sIgE和Df-sIgE)水平不符合正态分布,经对数转换后,SCIT组和SLIT组患者免疫治疗前后的血清IgE水平见表 2。患者基线血清tIgE、Dp-sIgE和Df-sIgE水平SCIT组明显高于SLIT组,差异均有统计学意义(P<0.05)。免疫治疗1年后与治疗前相比较,两组血清tIgE、Dp-sIgE和Df-sIgE水平的变化均无统计学意义(P>0.05)。
| 表 2 SCIT组和SLIT组患者治疗1年后血清IgE水平的变化(lg转换,x±s) Table 2 Serum IgE levels in the SCIT and SLIT groups before and after 1 year treatment(lg,x±s) |
将患者按照治疗结局分为有效组(显效+有效)和无效组(无效+恶化)进行分层分析,如表 3所示,SCIT有效组的基线血清Dp-sIgE和Df-sIgE水平均显著高于无效组(P<0.05),而基线血清tIgE水平的差异无统计学意义(P>0.05)。免疫治疗1年后,有效组与无效组血清tIgE水平的变化均无统计学意义(P>0.05);有效组血清Dp-sIgE和Df-sIgE水平有下降趋势,但仅Dp-sIgE水平的下降有统计学意义(P<0.05);无效组血清Dp-sIgE和Df-sIgE水平均未见显著降低(P>0.05)。
| 表 3 SCIT有效组和无效组患者血清IgE水平的变化(lg转换,x±s) Table 3 Serum IgE levels in the SCIT group by efficiency(lg,x±s) |
如表 4所示,SLIT有效组的基线血清Df-sIgE水平显著高于无效组(P<0.05),而基线血清tIgE和Dp-sIgE水平的差异均无统计学意义(P>0.05)。免疫治疗1年后,有效组与无效组血清tIgE水平的变化均无统计学意义(P>0.05);有效组血清Dp-sIgE和Df-sIgE水平有下降趋势,但差异均无统计学意义(P>0.05);无效组血清Dp- sIgE和Df- sIgE水平均未见显著降低(P>0.05)。
| 表 4 SLIT有效组和无效组患者血清IgE水平的变化(lg转换,x±s) Table 4 Serum IgE levels in the SLIT group by efficiency(lg,x±s) |
免疫治疗有效患者与无效患者在基线血清IgE水平上有一定的差异,使用ROC曲线将患者的基线血清IgE水平与治疗效果相联系,进行预测指标的筛选。SCIT组使用标准化屋尘螨(Dp)变应原制剂进行免疫治疗,对SCIT组选取血清Dp-sIgE水平、Dp-sIgE+Df-sIgE水平、Dp-sIgE/tIgE比值、(Dp-sIgE+Df-sIgE)/tIgE比值等4个指标,分别与治疗结果相关联,绘制4条ROC曲线(4个指标分别表示为d1、d1+d2、d1/t、(d1+d2)/t,见图 1),AUC及P值见表 5。其中d1/t所对应的ROC曲线最靠近曲线图的左上角,且AUC最大(AUC=0.851,P=0.000),提示血清Dp-sIgE/tIgE这一指标对SCIT疗效具有最佳预测效果。根据约登指数最大原则,确定基线血清Dp-sIgE/tIgE比值的最佳cut-off值为11.95%,敏感性为71.9%,特异性为83.3%。

|
图 1 SCIT组ROC曲线 Figure 1 ROC curves in the SCIT group |
| 表 5 SCIT组和SLIT组患者的ROC曲线下面积 Table 5 Area under curve of the SCIT and SLIT groups |
SLIT组使用标准化粉尘螨(Df)滴剂进行免疫治疗,对SLIT组选取血清Df-sIgE水平、Dp-sIgE+Df-sIgE水平、Df-sIgE/tIgE比值、(Dp-sIgE+Df-sIgE)/tIgE比值等4个指标,分别与治疗结果相关联,绘制4条ROC曲线(4个指标分别表示为d2、d1+d2、d2/t、(d1+d2)/t,见图 2),AUC及P值见表 5。其中d2所对应的ROC曲线最靠近曲线图的左上角,且AUC最大(AUC=0.697,P=0.014),提示血清Df-sIgE这一指标对SLIT疗效具有 最佳预测效果。根据约登指数最大原则,确定基线血清Df-sIgE水平的最佳cut-off值为27.95 IU/mL(4级),敏感性为52.6%,特异性为85.0%。
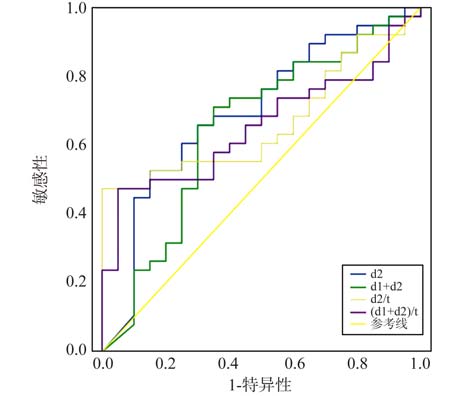
|
图 2 SLIT组ROC曲线 Figure 2 ROC curves in the SLIT group |
AR是严重影响患者生活质量的鼻黏膜慢性炎症性疾病,WHO早在1997年就提出变应原回避、药物治疗、免疫治疗和患者教育的“四位一体”综合防治策略。随后,ARIA指南2008年版[11]及2010年版[12]均强调免疫治疗可用于中-重度持续性AR的治疗,并认为该疗法能干预变应性疾病的自然进程。在“以患者为中心”的医疗导向下,患者对疗效的评价对治疗结局及依从性具有重要的影响。本研究中,我们对尘螨致敏的中-重度持续性AR患者行免疫治疗(SCIT或SLIT),并以患者主观评价的方式评估治疗的有效性。从结果来看,SCIL组与SLIT组治疗1年的有效率分别为64.0%和65.5%,与当前报道的免疫治疗总体有效率为60%~90%[13]相符合,随着疗程持续2~3年,其有效率有可能还会提高。当然,患者对疗效的主观评价在不同研究中存在差异,de Bot等[14]报道的针对尘螨过敏AR患儿2年期SLIT的自评有效率为58%,而Bergmann等[10]基于尘螨变应原剂量的不同,1年期SLIT的成年患者自评有效率波动于73.1%~80.5%。可见患者对疗效的主观评价可能受到年龄、疗程长短、变应原剂量等方面的影响,但总体而言免疫治疗的疗效是可以获得患者的主观肯定的,而这对提高患者的依从性具有重要意义。
SCIT与SLIT是免疫治疗目前最主要的两种途径,二者的优劣尚无统一的结论。本研究由于采用的是非随机对照研究,且两组患者的基线血清IgE水平存在差异,这为两组的直接比较带来困难,但从结果看无论是SCIT还是SLIT组均未见严重的全身不良反应发生,且两种治疗方式的1年有效率无统计学差异。一方面说明尘螨变应原免疫治疗的安全性,另一方面也提示两种治疗方法均可获得患者肯定,临床可结合实际情况及患者的主观意愿个性化选择治疗方式。就安全性而言,SCIT的全身不良反应发生率可能更高[15];就治疗效果而言,Chelladurai等[16]通过系统评价表明:中等程度的证据显示SCIT在减轻AR症状方面优于SLIT,但同时也指出需要更多的高质量研究去验证这一结论。
AR的主要临床表现为阵发性喷嚏、清水样涕、鼻痒和鼻塞,其产生机制为易感个体吸入变应原与鼻黏膜中肥大细胞表面的IgE结合,导致组胺、白三烯等一系列炎症介质释放,作用于鼻黏膜的神经末梢及血管,从而引发鼻部症状[17]。从我们的统计结果可发现,无论是免疫治疗有效患者缓解最明显的症状,还是治疗无效困扰最明显的症状均为喷嚏与流涕,提示这2个症状是困扰AR患者的主要症状,加强对喷嚏及流涕的控制有助于提高患者对免疫治疗疗效的认同感。同时,我们也观察到在认为免疫治疗无效的患者中有一部分(18.4%)认为鼻塞是最困扰的症状,与流涕症状相当(同为18.4%)。值得注意的是,2015年美国耳鼻咽喉头颈外科学会制定的“变应性鼻炎临床指南”[18]中关于AR定义,将伴随症状描述为鼻塞、流涕、喷嚏和/或鼻痒,这无疑是强调了AR症状中鼻塞的重要性,所以在治疗过程中也应重视鼻塞的对症治疗。
AR是由IgE介导的I型变态反应性疾病,由于血清tIgE水平常受到人种、环境,尤其是寄生虫感染等多种非特异性因素的影响[18],并不能很好地反映机体的过敏状态,因此在免疫治疗过程中血清sIgE水平的变化成为关注焦点,但目前无一致的结论[19-20]。有研究显示,免疫治疗后血清sIgE水平的降低落后于临床症状改善,在治疗早期患者临床症状即有改善,但血清sIgE却短暂升高,随着数月直至数年的持续治疗,sIgE水平逐渐降低[21]。本研究中,经过1年免疫治疗,SCIT与SLIT组血清抗体水平(tIgE、Dp-sIgE和Df-sIgE)均无显著变化。进一步按治疗的有效与否进行分层分析,发现SCIT与SLIT组有效患者的血清sIgE均呈现出一定的下降趋势,但仅SCIT有效患者血清Dp-sIgE水平的下降有统计意义,而两治疗组无效患者血清sIgE水平均未见明显下降。可见患者疗效的取得与血清sIgE的变化并无明确的相关性,但值得注意的是,SCIT治疗有效患者血清sIgE更容易降低。Zhao等[22]研究显示,对尘螨过敏的AR患者进行为期1年的SCIT,1年后患者的症状显著改善但血清sIgE相对于治疗前无明显变化,血清sIgG4却随着治疗的进程逐渐升高,且sIgG4的升高与sIgE阻断活性具有强正相关性,sIgE阻断活性增加,患者症状改善。Shamji等[23]通过功能性实验发现,血清IgG相关的抑制活性(sIgE阻断因子、阻断IgE-FAB活性)与AR患者药物评分呈反比,而血清IgG4水平却未见这种相关性。血清IgG相关的抑制活性反应的是一种免疫治疗所诱导的可阻断sIgE与特异性抗原结合的能力,血清抗体抑制活性的增加可能是相关阻断抗体的增加(如sIgG4),亦或是sIgE降低等多种因素引起,故临床症状的改善与血清sIgE水平降低与否并无固定的关系,但随着治疗时间的延长,治疗有效患者sIgE抑制活性持续增加[6],因此血清sIgE水平降低的可能性增加。由于我们在临床治疗过程中未常规检测血清sIgG4,故本研究无法将该指标与血清sIgE进行比较,有待于在今后的研究中进一步探讨。
在决定进行免疫治疗之前,确定什么样的患者可接受该治疗是必要的。理论上,所有因吸入性变应原引起IgE介导的Ⅰ型变态反应而出现临床症状的患者均可接受免疫治疗[15]。然而治疗中存在部分患者疗效不佳,故临床需要一个生物指标物对治疗的有效性进行预测,但目前国内外关于免疫治疗的主要临床指南中均无相关疗效预测及客观评价的推荐指标。这种生物指标物应该是基于血清或血浆的检测,而非基于复杂的T细胞检测,文献报道可供选择的标志物主要有IgE、IgG1、IgG4、sIgE/tIgE、sIgG4/sIgE以及抗体功能性实验如IgE-FAB抑制活性、嗜碱粒细胞敏感性等[24]。考虑到预测指标应具有实用性、易于检测,技术可靠、方便推广,并有良好的敏感性和特异性等内在要求,而目前报道的生物标志物均无法很好地满足这些要求。正因为如此,世界变态反应组织“舌下免疫治疗意见书(2013年版)”[6]指出:由于尚无其他可常规用于免疫治疗患者筛选的生物指标物,所以当前阶段只能依靠血清sIgE检测对患者进行筛选。在我们的研究中,发现SCIT和SLIT治疗1年的有效患者与无效患者在基线血清sIgE水平上存在一定的差异,应用ROC曲线将基线血清IgE水平与免疫治疗效果相关联,结果显示SCIT组4个指标、SLIT组2个指标的AUC均具有统计学意义(表 5),最终得出SCIT组Dp-sIgE/tIgE比值>11.95%、SLIT组Df-sIgE水平>27.95 IU/mL(4级)时患者更容易取得疗效,为最佳预测指标,提示基线血清IgE水平可用于免疫治疗的疗效评估。国外学者对不同变应性疾病及治疗年限的患者进行了类似的研究:Tosca等[25]针对AR伴哮喘患儿的3年期SILT研究显示,基线血清尘螨sIgE的cut-off值为>10 kU/L(3级);Ciprandi等[26]针对AR和/或哮喘患者的3年期SILT研究显示,基线血清桦树花粉sIgE的cut-off值为>9.74 kU/L(3级);Di Lorenzo等[27]针对AR和/或哮喘患者的4年期免疫治疗(SCIT或SLIT)显示,基线血清sIgE/tIgE比值的cut-off值>16.2%时,预测治疗有效的敏感性(97.2%)和特异性(88.1%)达最佳。对于研究结果的差异,治疗时间的长短可能具有重要的影响。国内有研究[28]表明,在免疫治疗的各个时间节点,随着疗程的进展,有效率的提升,未控制组例数逐渐下降,而其所对应的平均基线sIgE水平也随之呈进行性降低。所以,基线血清sIgE抗体水平的cut-off值及其敏感性、特异性可能随着免疫治疗时间的延长而呈现出动态变化,而本文由于观察时间较短可能导致有效率相对较低,进而导致预测指标的cut-off值偏高及其预测敏感性偏低。
综合各研究可以发现,虽然由于免疫治疗的治疗方式、疗程长短、患者类型、疗效判定标准等因素的不同,最佳预测指标及cut-off值可能有所不同,但总体来说患者治疗前的基线血清sIgE水平可在一定程度上对治疗效果进行预测,sIgE水平较高或sIgE/tIgE比值较大的患者更容易取得满意疗效。当然,由于本研究样本量较少、观察时间偏短,可能会对研究结果产生一定影响,有待于今后进一步深入探讨。
| [1] |
Zhang Y, Zhang L.
Prevalence of allergic rhinitis in China[J]. Allergy Asthma Immunol Res , 2014, 6 (2) : 105–113.
DOI:10.4168/aair.2014.6.2.105 ( 0) 0)
|
| [2] |
程雷.
变应性鼻炎的特异性免疫治疗[J]. 山东大学耳鼻喉眼学报 , 2011, 25 (5) : 33–35.
( 0) 0)
|
| [3] |
程雷.
舌下免疫治疗在中国的临床应用及若干问题探讨[J]. 中华耳鼻咽喉头颈外科杂志 , 2015, 50 (8) : 617–618.
( 0) 0)
|
| [4] |
中华耳鼻咽喉头颈外科杂志编委会鼻科组, 中华医学会耳鼻咽喉头颈外科学分会鼻科学组.
变应性鼻炎特异性免疫治疗专家共识[J]. 中华耳鼻咽喉头颈外科杂志 , 2011, 46 (12) : 976–980.
( 0) 0)
|
| [5] |
Jutel M, Agache I, Bonini S, et al.
International consensus on allergy immunotherapy[J]. J Allergy Clin Immunol , 2015, 136 (3) : 556–568.
DOI:10.1016/j.jaci.2015.04.047 ( 0) 0)
|
| [6] |
Canonica G W, Cox L, Pawankar R, et al.
Sublingual immunotherapy: World Allergy Organization position paper 2013 update[J]. World Allergy Organ J , 2014, 7 (1) : 6.
DOI:10.1186/1939-4551-7-6 ( 0) 0)
|
| [7] |
Walker S M, Durham S R, Till S J, et al.
Immunotherapy for allergic rhinitis[J]. Clin Exp Allergy , 2011, 41 (9) : 1177–1200.
DOI:10.1111/cea.2011.41.issue-9 ( 0) 0)
|
| [8] |
中华医学会耳鼻咽喉头颈外科学分会鼻科学组, 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组.
变应性鼻炎诊断和治疗指南(2015年, 天津)[J]. 中华耳鼻咽喉头颈外科杂志 , 2016, 51 (1) : 6–24.
( 0) 0)
|
| [9] |
中华耳鼻咽喉头颈外科杂志编委会鼻科组, 中华医学会耳鼻咽喉头颈外科学分会鼻科学组.
变应性鼻炎诊断和治疗指南(2009年, 武夷山)[J]. 中华耳鼻咽喉头颈外科杂志 , 2009, 44 (12) : 977–978.
( 0) 0)
|
| [10] |
Bergmann K C, Demoly P, Worm M, et al.
Efficacy and safety of sublingual tablets of house dust mite allergen extracts in adults with allergic rhinitis[J]. J Allergy Clin Immunol , 2014, 133 (6) : 1608–1614.
DOI:10.1016/j.jaci.2013.11.012 ( 0) 0)
|
| [11] |
Bousquet J, Khaltaev N, Cruz A A, et al.
Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen)[J]. Allergy , 2008, 63 (Suppl86) : 8–160.
( 0) 0)
|
| [12] |
Brozek J L, Bousquet J, Baena-Cagnani C E, et al.
Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 revision[J]. J Allergy Clin Immunol , 2010, 126 (3) : 466–476.
DOI:10.1016/j.jaci.2010.06.047 ( 0) 0)
|
| [13] |
Ciprandi G, Tosca M A, Silvestri M.
The practical role of serum allergen-specific IgE as potential biomarker for predicting responder to allergen immunotherapy[J]. Expert Rev Clin Immunol , 2014, 10 (3) : 321–324.
DOI:10.1586/1744666X.2014.872032 ( 0) 0)
|
| [14] |
de Bot C M, Moed H, Berger M Y, et al.
Sublingual immunotherapy not effective in house dust mite-allergic children in primary care[J]. Pediatr Allergy Immunol , 2012, 23 (2) : 150–158.
( 0) 0)
|
| [15] |
Zuberbier T, Bachert C, Bousquet P J,et al. GA2LEN/EAACI pocket guide for allergen-specific immunotherapy for allergic rhinitis and asthma. Allergy, 2010, 65(12):1525-1530.
( 0) 0)
|
| [16] |
Chelladurai Y, Suarez-Cuervo C, Erekosima N, et al.
Effectiveness of subcutaneous versus sublingual immunotherapy for the treatment of allergic rhinoconjunctivitis and asthma: a systematic review[J]. J Allergy Clin Immunol Pract , 2013, 1 (4) : 361–369.
DOI:10.1016/j.jaip.2013.04.005 ( 0) 0)
|
| [17] |
Okubo K, Kurono Y, Fujieda S, et al.
Japanese Guideline for Allergic Rhinitis 2014[J]. Allergol Int , 2014, 63 (3) : 357–375.
DOI:10.2332/allergolint.14-RAI-0768 ( 0) 0)
|
| [18] |
Seidman M D, Gurgel R K, Lin S Y, et al.
Clinical practice guideline: Allergic rhinitis[J]. Otolaryngol Head Neck Surg , 2015, 152 (Suppl 1) : S1–S43.
( 0) 0)
|
| [19] |
Yukselen A, Kendirli S G, Yilmaz M, et al.
Effect of one-year subcutaneous and sublingual immunotherapy on clinical and laboratory parameters in children with rhinitis and asthma: a randomized, placebo-controlled, double-blind, double-dummy study[J]. Int Arch Allergy Immunol , 2012, 157 (3) : 288–298.
DOI:10.1159/000327566 ( 0) 0)
|
| [20] |
Radulovic S, Wilson D, Calderon M, et al.
Systematic reviews of sublingual immunotherapy (SLIT)[J]. Allergy , 2011, 66 (6) : 740–752.
DOI:10.1111/j.1398-9995.2011.02583.x ( 0) 0)
|
| [21] |
Akdis C A, Akdis M.
Mechanisms of allergen-specific immunotherapy and immune tolerance to allergens[J]. World Allergy Organ J , 2015, 8 (1) : 17.
DOI:10.1186/s40413-015-0063-2 ( 0) 0)
|
| [22] |
Zhao D, Lai X, Tian M, et al.
The functional IgE-blocking factor induced by allergen-specific immunotherapy correlates with IgG4 antibodies and a decrease of symptoms in house dust mite-allergic Children[J]. Int Arch Allergy Immunol , 2016, 169 (2) : 113–120.
DOI:10.1159/000444391 ( 0) 0)
|
| [23] |
Shamji M H, Ljorring C, Francis J N, et al.
Functional rather than immunoreactive levels of IgG4 correlate closely with clinical response to grass pollen immunotherapy[J]. Allergy , 2012, 67 (2) : 217–226.
DOI:10.1111/all.2012.67.issue-2 ( 0) 0)
|
| [24] |
Calderon M, Cardona V, Demoly P.
One hundred years of allergen immunotherapy European Academy of Allergy and Clinical Immunology celebration: review of unanswered questions[J]. Allergy , 2012, 67 (4) : 462–476.
DOI:10.1111/all.2012.67.issue-4 ( 0) 0)
|
| [25] |
Tosca M, Silvestri M, Accogli A, et al.
Serum-specific IgE and allergen immunotherapy in allergic children[J]. Immunotherapy , 2014, 6 (1) : 29–33.
DOI:10.2217/imt.13.145 ( 0) 0)
|
| [26] |
Ciprandi G, Silvestri M.
Serum specific IgE: a biomarker of response to allergen immunotherapy[J]. J Investig Allergol Clin Immunol , 2014, 24 (1) : 35–39.
( 0) 0)
|
| [27] |
Di Lorenzo G, Mansueto P, Pacor M L, et al.
Evaluation of serum s-IgE/total IgE ratio in predicting clinical response to allergen-specific immunotherapy[J]. J Allergy Clin Immunol , 2009, 123 (5) : 1103–1110.
DOI:10.1016/j.jaci.2009.02.012 ( 0) 0)
|
| [28] |
刘靖, 张晓波, 冯海燕, 等.
影响儿童哮喘尘螨特异性免疫疗效的因素分析[J]. 中国当代儿科杂志 , 2013, 15 (10) : 854–859.
LIU Jing, ZHANG Xiaobo, FENG Haiyan, et al. Impact factors for efficacy of specific immunotherapy in children with dust mite allergic asthma[J]. Chin J Contem Pedia , 2013, 15 (10) : 854–859. (  0) 0)
|
 2016, Vol. 30
2016, Vol. 30

