甲状腺髓样癌(medullary thyroid carcinoma,MTC)是来源于神经嵴的神经内分泌肿瘤,约占所有甲状腺癌的3%~5%,恶性程度在甲状腺癌中较高,预后相对较差。其临床表现以腹泻(≥3次/d)、脸部潮红、瘙痒症为主(与滤泡旁细胞分泌的降钙素或降钙素基因相关肽有关)。根据疾病的遗传特征,甲状腺髓样癌可分为散发型(sporadic MTC,约占70%~80%)和遗传型(hereditary MTC,约占25%)。遗传型甲状腺髓样癌可分为三类,包括:多发性内分泌腺瘤2A型(multiple endocrine neoplasia type 2A,MEN 2A,55%~60%) ,多发性内分泌腺瘤2B型(multiple endocrine neoplasia type 2B,MEN 2B,5%~10%)以及家族性甲状腺髓样癌(familial MTC,FMTC,35%~40%)。生殖细胞RET原癌基因(REarranged during Transfection) 的错义突变、重排和丢失与遗传型甲状腺髓样癌有关,而散发型则与肿瘤的体细胞RET基因突变相关。散发型MTC最常见的表现为无症状的甲状腺结节,确诊时通常年龄较大;MEN 2A典型的发病年龄为30~40岁,包括3个显著的特征(可同时发生):甲状腺髓样癌(100%)、嗜铬细胞瘤(pheochromocytoma,PHEO,约57%)、原发性甲状旁腺功能亢进(primary hyperparathyproidism,PHPT,约15%~30%);MEN 2B发病年龄较早,中位年龄在23~28岁,侵袭性也最高,其特点是不发生PHPT且伴明显发育缺陷,包括骨骼肌肉异常(如马凡体型、漏斗胸)、肠和口腔黏膜神经瘤病等,而胃肠道症状如肠梗阻通常是患者就诊的首发症状。FMTC是MEN 2A的一种特殊类型,甲状腺髓样癌是其唯一的表现[1]。
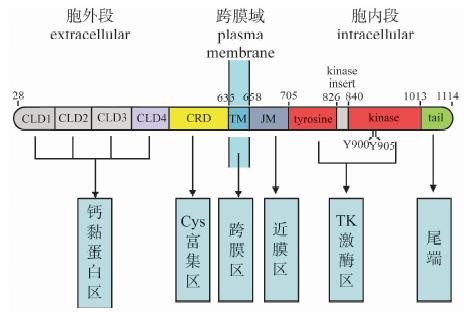
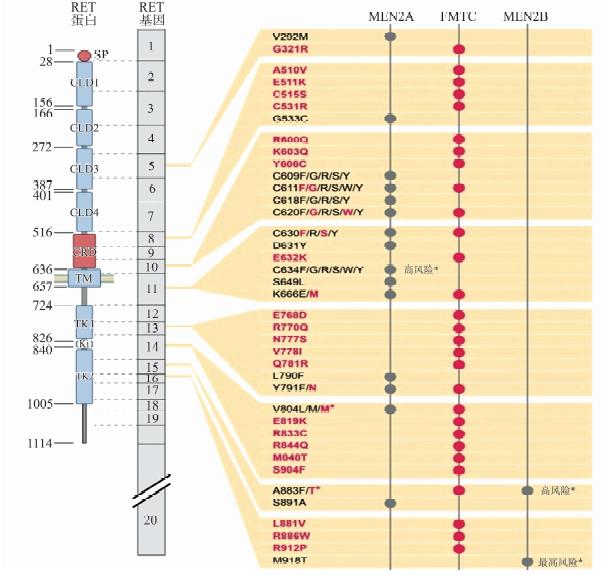
1 致病机制及精准治疗原癌基因RET突变是大多数MTC患者的主要致病因素[2]。RET基因定位于人类染色体10q11.2,包含21个外显子,该基因编码酪氨酸激酶受体蛋白。RET蛋白由三个结构域构成: N端胞外结构域(含配体结合域,4个钙黏蛋白结构域及富含半胱氨酸结构域),疏水跨膜结构域及胞内酪氨酸激酶结 构域(图 1)。RET基因突变最常见于外显子10、11(胞外配体结构域)、13、14、15和16 (酪氨酸激酶结构域)。在散发型患者中,40%~50%病变组织存在RET基因突变,突变位点在密码子位置608、611、618、629、630、634、649、641、918及922上,密码子M918T突变最常见。遗传型甲状腺髓样癌中,MEN 2A、MEN 2B及FMTC分别有98%、95%及88%存在生殖细胞RET基因突。MEN 2A主要由外显子10(密码子609、611和618)和外显子11(密码子634)突变所致。MEN 2B患者则主要归因于M918T(外显子16)突变。2%~3%的患者存在隐匿性的密码子A883F(外显子10)突变。FMTC与外显子10(密码子609、611、618、620)、外显子11(密码子634)、外显子13(密码子768)、外显子14(密码子804)的突变关系最密切。当FMTC发生外显子11(密码子634)的基因突变时,几乎从来不发生C634R突变,而最常见的是C634Y的突变(图 2)。
|
图1 RET蛋白结构示意图 |
|
图2 RET基因点突变和对应临床表型以及精准治疗模型。RET基因外显子点突变一一对应于RET蛋白上的各个区域:钙黏蛋白域(CLD),半胱氨酸富集域(CRD),跨膜域(TM),胞内酪氨酸激酶域(TK);依据2015年ATA指南,M918T为最高风险等级,A883F和C634突变为高风险等级,其余类型突变则为中等风险等级。选自Samuel A. Wells,Multiple Endocrine Neoplasia Type 2 and FamilialMedullary Thyroid Carcinoma: An Update,2013。 |
影响疾病预后的因素主要有诊断时的疾病分期、肿瘤大小和淋巴结侵犯程度、肿瘤的遗传类型(散发型和遗传型)、患者的年龄和性别以及降钙素倍增时间等。而不同的突变位点也可导致预后上的差异。如侵袭性最高的MEN 2B患者中,超过95%发生M918T突变,而有M918T突变的MTC患者的10年生存率约为45%,无此突变的患者这一数值高达90%。
2 临床治疗策略在所有甲状腺髓样癌患者中,25%为遗传型,其余属于散发型。现已根据遗传型甲状腺髓样癌的不同突变位点,制定出相应的个体化治疗方案,接近精准医疗。从最早期的预防切除,到早期病变、局部晚期和非常晚,期的病变,都采取不同的治疗策略。这些患者外科干预的相同点是甲状腺全部切除术个体化或进准治疗的区别在于预防切除的时机,淋巴结清扫的范围。对于非手术的进准治疗在于靶向药物的治疗。
2.1 预防性甲状腺全部切除术(癌变前切除)这是遗传性甲状腺髓样癌家系中特有的一种治疗方法。遗传性甲状腺髓样癌属常染色体显性遗传,由于携带有RET突变的个体后代有50%的概率会遗传此突变;不同位点和不同突变方式使得其临床恶性程度不同。由于RET的突变位点、碱基置换类型与疾病的表型密切相关,目前遗传型MTC的治疗正逐渐由经验式治疗向个体化治疗方向转变,强调根据基因突变位点的不同进行精准化治疗。
2015年美国甲状腺协会指南根据甲状腺髓样癌的侵袭性将其划分为最高风险,高风险和中等风险3个等级。最高风险(highest risk,HST)包含M918T,高风险(high risk,H)含有634位点上的所有突变和A883F,中等风险(moderate risk,MOD)包含除上述之外的其他基因突变。该指南按照3个不同等级制定了相应的干预策略(表 1)[3]。MEN 2B患儿应在1岁以内行预防性全甲状腺切除术。但考虑到术后可能并发甲状旁腺功能低下,术者应根据以下因素判断是否行中央区淋巴结清扫:①是否有可疑淋巴结转移;②是否能够良好地辨认甲状旁腺;③是否能够在原位保留正常的甲状旁腺组织或自体移植。ATA-H突变的儿童要在5岁之前行预防性甲状腺全切手术,若血清降钙素超过40 pg/mL或有其他证据证实淋巴结转移,应行中央区淋巴结清扫;ATA-MOD突变的患者手术时间可延迟到5岁以后,但应根据血清降钙素随时调整。
| 表1 遗传型MTC患者预防性手术时机(2015 ATA指南) |
由于遗传型MTC继发于生殖细胞RET原癌基因突变,理论上所有的滤泡旁细胞都有可能受到影响,所以要行全甲状腺切除术。研究显示,90%的遗传型患者和20%的散发型患者肿瘤为多发性。虽然遗传型倾向于双侧多发病灶,散发型通常为单侧单发病灶,但由于很多患者在MTC得到诊断和治疗时不能及时得到基因检测结果,且MTC有腺内播散可能,所以不论是散发型还是遗传型,很多国外学者都选择行甲状腺全切术。2015年ATA指南中推荐的标准术式也是“甲状腺全切除+预防性颈中央区淋巴结清扫”[3]。王笑春等[4]认为,散发型单侧甲状腺病灶至少应行患侧腺叶+峡部切除,最好行甲状腺全切除术;对双侧甲状腺病灶或双颈转移及遗传型MTC,应行甲状腺全切除。也有国外的一些学者认为,由于甲状腺旁细胞主要位于甲状腺叶的上部,所以主张行器官保留性甲状腺切除术。由于峡部不存在分泌降钙素的细胞,也有学者推荐行保留峡部的双侧叶切除。而Romanchishen等[5]通过对226例MTC患者的分析研究认为,器官保留性甲状腺切除术仅适用于T1N0M0期(即肿瘤局限于甲状腺内,直径≤2 cm,无淋巴结转移和远处转移)的散发型MTC患者。
2.2.2 淋巴结的处理不管原发肿瘤的大小,颈中央区淋巴结侵犯的概率都很高,而B超对中央区淋巴结检查的敏感性较差,且二次手术并发手术并发症的概率较高,在初次行甲状腺切除术时加行系统性淋巴结清扫会显著降低MTC的复发率和再手术率,且能降低未来可能的并发症,如侵犯喉返神经或呼吸消化道而导致的发声、吞咽功能的丧失。为提高治愈率、降低病灶残留和再手术风险,2015年ATA指南推荐:临床上诊断MTC或高度怀疑MTC的患者,若没有原发肿瘤晚期局部浸润的证据,体格检查和颈B超无颈淋巴结转移的证据或仅有中央区淋巴结转移也未发现远处转移,则应行甲状腺全切除术和预防性颈中央区淋巴结清扫(颈VI)。若B超显示颈侧区有淋巴结转移时应加行颈侧区淋巴结清扫。通过对颈中央区淋巴结转移与颈侧淋巴结转移关系的研究,国内外学者有相似的结论。Machens等[6]通过对195例MTC患者的研究发现,有1个或2个颈中央区淋巴结转移的39例患者中约77%有同侧颈淋巴结转移,当中央区淋巴结转移≥4个时则有约98%的患者有同侧颈淋巴结的侵犯,认为同侧颈淋巴结侵犯与颈中央区淋巴结转移数量相关。所以也有学者主张在毗邻气管的颈中央区淋巴结转移阳性时应行预防性的颈侧区部分淋巴结清扫[7]。王笑春等[4]通过对46例MTC患者的研究认为,对双侧甲状腺病灶或双颈淋巴结有转移者应行双中央区+双侧颈清扫术;对单侧病灶伴单侧颈淋巴结转移者应行同侧中央区+侧颈清扫,不主张行对侧预防性颈清扫;对N0者应至少行同侧中央区清扫。
对于预防性颈侧淋巴结清扫的研究显示,无淋巴结转移患者获得的生化治愈率远高于有局部淋巴结转移的患者。有淋巴结转移患者的预后相对较差,当颈淋巴结受累时颈淋巴结清扫对疾病分期和局部控制有很重要的意义,但并没有证据显示行预防性淋巴结清扫或增加淋巴结清扫的数量会改善MTC患者的预后,特别是在有多个淋巴结阳性时。
2.2.3 甲状旁腺的处理行淋巴结清扫时应注意保护喉返神经和甲状旁腺。以往认为,较完全的淋巴结清扫将增加甲状旁腺切除或血供破坏的风险。ATA指南中推荐应尽量在原位保留正常的甲状旁腺组织,否则应把正常的甲状旁腺组织移植到颈部或前臂。移植组织放置的部位取决于RET突变的类型。若有发生PHPT的庞大的家族史,或有发生PHPT高风险的相关RET基因突变的家族史,则应把甲状旁腺组织移植到前臂。若患者为MEN 2B、FMTC或有低危PHPT的突变,则甲状旁腺组织应被移植到胸锁乳突肌上。由于自体移植的甲状旁腺在4~8周后才会发生作用,所以在此期间应给予钙和维生素D替代治疗。
2.2.4 甲状腺全切患者的激素替代治疗甲状腺全切的患者应常规给予甲状腺素替代治疗。一般餐前30~60 min给药,高脂肪饮食和引用咖啡会不同程度地影响药物的吸收。通常根据促甲状腺激素(thyrotropin thyroid stimulating hormone,TSH)的值来调整替代药物的剂量,由于滤泡旁细胞肿瘤不依赖促甲状腺激素,而且没有证据显示T4疗法抑制促甲状腺激素分泌后可减少MTC的复发或提高MTC患者的生存率,所以MTC患者甲状腺全切除后推荐的一般TSH值为1~2 mU/L。
2.2.5 甲状腺全切除患者的清甲治疗虽然,MTC病变组织并不摄取碘,但有些学者认为,术后应用131I消融可以通过摄取131I的甲状腺组织对肿瘤达到间接的辐射作用,但此观点并未被广泛接受。ATA指南中指出,在不伴有上皮来源的分化性甲状腺癌的情况下,不推荐MTC患者行术后放射碘治疗。然而现在一些学者认为,甲状腺全切术后应用131I外放射可消除残留的甲状腺组织来达到减少复发的目的,但此方面尚未有相关研究报道[8]。
2.3 局部晚期MTC治疗 2.3.1 手术治疗初次手术的范围主要依靠术者对疾病诊断和对肿瘤淋巴结侵犯模式的良好把握,这样术者可能在初次手术时就能有效地移除颈部的隐匿转移性病灶。但是MTC的术前确诊往往比较困难,多数患者尤其是散发型MTC患者往往表现为无症状的结节,所以有很多患者是在术后才被确诊为MTC。在我国,很多初次手术未发现明显淋巴结转移的患者仅做了甲状腺次全切除或仅摘除病变组织,对于这类患者则推荐术后进行RET基因检测、血清降钙素检测和B超检查,若发现有降钙素水平异常(高于正常范围)或B超发现有肿瘤残留时则应行补全性甲状腺切除和颈部中央区及同侧颈部淋巴结清扫。在基因检测后若证实为遗传型MTC患者则强烈建议行甲状腺全切除术。报道称,有超过50%的患者在诊断时就已发生颈淋巴结转移。即使是双侧颈淋巴结转移也较为常见,大于25%。研究显示,约有75%~90%的无颈淋巴结转移MTC患者可获得生化治愈,然而即使经过积极的手术治疗,也只有20%~30%的颈淋巴结转移阳性的患者获得了生化治愈,而有大于10个颈淋巴结转移获得生化治愈的患者更少,约为4%。Finny等[9]报道,75%患者术后的基础血清降钙素水平升高,对9例患者行临床和放射学检查发现有4例患者有局部肿瘤的复发。对于这部分术后影像学阳性的患者,则需行二次手术。然而,对于术后有降钙素水平的升高而无影像学证据的患者的治疗尚有争议,即对这些患者采取暂时保守治疗或行广泛区域淋巴结清扫以使降钙素降至正常水平尚无统一标准。再次手术1/3的患者能够得到生化治愈。然而这种情况下,由于广泛区域淋巴结清除的价值尚未明确,再加上再次手术时辨认喉返神经和甲状旁腺等异常困难,可能会导致胸部导管瘘、甲状旁腺功能低下以及对喉返神经的损伤。又有一些研究结果显示,当有甲状腺外或淋巴结外侵犯时,二次手术并未显示出总生存率方面的改善[10]。所以再次手术同样存在很高的风险性和不确定性。
2.3.2 辅助化疗MTC患者不提倡常规应用化疗药物。若病情进展迅速,出现转移性MTC残留,或复发不便进行其他姑息性治疗的患者可以考虑接受该项治疗,但化疗对于MTC效果较有限。目前效果最佳的药物是氮烯唑胺、五氟尿嘧啶和阿霉素,但可部分获得缓解的最佳效应也仅有10%~20%,且反应时间短暂。
2.3.3 辅助放疗目前,外放射治疗在MTC治疗中的作用尚有争议。尽管尚不能确定是否能够改善总生存率,但外放射治疗可能对高危患者的局部疾病控制有所帮助。Schwartz等[11]仅在9%的患者中发现了慢性不良反应。Call等[12]对11例接受术后辅助放疗的患者进行研究,未发现明显的不良反应。颈部有肿瘤残余的高危(淋巴结阳性、甲状腺外侵犯、术后肉眼观察肿瘤有残留或术后切缘阳性)患者,ATA指南推荐术后行外放射治疗来控制局部疾病。有研究提示,接受外放射治疗的患者10年局部无复发率或控制率要远好于未接受外放射治疗的患者[13]。但是,手术肉眼上比较完全,而术后降钙素水平持续较高但无阳性远处转移的患者在广泛切除术后应用外放射治疗尚有争议。有些医师担心由于放疗后会导致局部瘢痕或纤维增生而阻碍后续手术的进行,以及外放射可能会引起其他一些不必要的伤害。而Call等[12]认为术后应用辅助外放疗可以有效地减少后续手术的必要性,特别是对于高风险的患者更是如此。目前对放化疗方面的研究仍在进行。
2.4 局部非常晚期或远处转移性MTC 2.4.1 手术姑息治疗当MTC患者出现远处转移时,一般认为是不可治愈的。当肿瘤出现远处转移时,手术治疗的目的通常是应患者的要求,达到疾病暂时的缓解和减少并发症,以提高患者的生活质量,如维持正常的发声和吞咽功能。ATA指南中指出[8],大量颈外转移的患者,其颈部治疗(包括手术)的主要目的是保留发声和吞咽功能;少量颈外转移或肿瘤局限于颈部的患者,用更为积极的方式来治疗局部浸润颈中央区部分的肿瘤,可能更有益于防止局部肿瘤的复发;单侧喉返神经的切除和外放射治疗适用于部分患者。虽然MTC可致命,但其生长缓慢,有些患者的转移性MTC可能会在很长一段时间内处于稳定的状态,如肿瘤转移到肝脏后长期未进展或扩散。所以在考虑手术治疗时,要充分衡量合理的生活预期、肿瘤的低进展率与治疗所带来的效果与不良反应。
2.4.2 靶向药物治疗分子靶向药物凡德他尼和卡博替尼在局部晚期或转移MTC患者中的应用已使MTC的治疗模式进入了一个快速发展的时期。凡德他尼对M918T突变的散发型患者效果较好,而对MEN 2A患者的临床效果较差;且CEA倍增时间≤24个月的患者比CEA倍增时间>24个月的患者效果要好,因此凡德他尼适用于快速进展的疾病,而不推荐应用于无症状和惰性期MTC患者。Elisei等[14]对330例伴有影像学进展的转移性MTC患者临床试验结果显示,卡博替尼在无进展生存期、客观缓解率和生化缓解率上有较明显的提高,但总生存率尚待进一步评估。虽然在用药选择上还有很多尚待解决的问题,对于如何选用凡德他尼和卡博替尼尚无显著的差异指征,但是两者都有很明显的不良反应,所以在应用这两种药物时要谨慎把握,包括应用时机和剂量等。除了上述两种相对较成熟的药物外,还有许多作用于激酶受体的靶向药物正处于不同的临床试验阶段,如阿西替尼(Axitinib)、莫特塞尼(Motesanib)、索拉非尼(Sorafenib)、舒尼替尼(Sunitinib)、帕唑帕尼(Pazopanib)以及国产药物安罗替尼等,这些药物在II期临床试验阶段都表现出或多或少的效果(疾病缓解和疾病稳固),但最终的疗效还要等最终试验结束。
| [1] | Machens A, Gimm O, Hinze R, et al. Genotype-phenotype correlations in hereditary medullary thyroid carcinoma: oncological features and biochemical properties[J]. J Clin Endocrinol Metab, 2001, 86(3):1104-1109.( 1) 1) |
| [2] | Mulligan L M. RET revisited: expanding the oncogenic portfolio[J]. Nat Rev Cancer, 2014, 14(3):173-186.( 1) 1) |
| [3] | Wells S A Jr, Asa S L, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma[J]. Thyroid, 2015, 25(6):567-610.( 2) 2) |
| [4] | 王笑春, 易凡, 支凯林. 甲状腺髓样癌不同手术方式对预后影响(附46例报告)[J]. 临床军医杂志, 2006,34(3):305-306.( 2) 2) |
| [5] | Romanchishen A F, Lisovsky O V, Vabalayte K V. Choice of the optimal volume of surgery for patients with sporadic medullary thyroid cancer[J]. Inter J Head Neck Surgery, 2011, 2(1):11.( 1) 1) |
| [6] | Machens A, Hauptmann S, Dralle H. Prediction of lateral lymph node metastases in medullary thyroid cancer[J]. Br J Surgery, 2008, 95(5):586-591.( 1) 1) |
| [7] | Sippel R S, Muthusamy K, Herbert C. Current management of medullary thyroid cancer[J]. Oncologist, 2008, 13(5):539-547.( 1) 1) |
| [8] | Kloos R T, Eng C, Evans D B, et al. Medullary thyroid cancer: management guidelines of the American Thyroid Association[J]. Thyroid, 2009, 19(6):565-612.( 2) 2) |
| [9] | Philip F, Jacob J J, Nihal T, et al. Medullary thyroid carcinoma: a 20-year experience from a centre in South India[J]. Anz J Surgery, 2007, 77(3):130-134.( 1) 1) |
| [10] | Kandil E, Gilson M M, Alabbas H H, et al. Survival Implications of Cervical Lymphadenectomy in Patients with Medullary Thyroid Cancer[J]. Ann Surgical Oncol, 2010, 18(4):1028-1034.( 1) 1) |
| [11] | Schwartz D L, Vishal R, Stephanie S, et al. Postoperative radiotherapy for advanced medullary thyroid cancer-local disease control in the modern era[J]. Head & Neck, 2008, 30(7):883-888.( 1) 1) |
| [12] | Call J A, Caudill J S, Mciver B, et al. A role for radiotherapy in the management of advanced medullary thyroid carcinoma: the mayo clinic experience[J]. Rare Tumors, 2013, 5:e37.( 2) 2) |
| [13] | Cosma M P, Panariello L, Quadro L, et al. A mutation in the RET proto-oncogene in Hirschsprungs disease affects the tyrosine kinase activity associated with multiple endocrine neoplasia type 2A and 2B[J]. Biochem J, 1996, 314(Pt 2):397-400.( 1) 1) |
| [14] | Rossella E, Schlumberger M J, Müller S P, et al. Cabozantinib in progressive medullary thyroid cancer[J]. J Clin Oncol Official J Am Society Clin Oncol, 2013, 31(29):3639-3646.( 1) 1) |
 2016, Vol. 30
2016, Vol. 30