2. 山东医学高等专科学校药理学教研室,山东 临沂 276002
2. Department of Phamacology, Shandong Medical College, Linyi 276002, Shandong, China
变应性鼻炎(allergic rhinitis,AR)是由IgE介导的以嗜酸粒细胞(eosinophil,EOS)、肥大细胞等浸润为特征的鼻黏膜非感染性炎性疾病,其中EOS被认为是AR 发病机制中极为重要的效应细胞和免疫调节细胞。辅助性T(T hellper,Th)细胞(Th1/Th2)比例失衡导致Th1细胞功能相对抑制,Th2细胞功能相对亢进是其重要的发病机制之一。IFN-γ是主要的Th1型细胞因子,能抑制Th0细胞向Th2细胞分化,从而抑制 IL-4、IL-5、IL-l3 等Th2型细胞因子的产生,进而抑制 IgE 的生成和 EOS 的活性。本实验通过建立AR大鼠模型,探讨鼻腔滴入重组γ干扰素(interferon gamma,IFN-γ)对AR大鼠鼻腔灌洗液中EOS凋亡及Eotaxin水平的影响,旨在为IFN-γ治疗AR提供新的理论依据。
1 材料与方法 1.1 实验动物及分组精选SPF级健康雄性Wistar大鼠40只,体质量200~250 g(山东大学实验动物中心提供),在室温22 ℃~24 ℃下饲养,自由进食水,每天光照12 h,饲养于标准Ⅱ级动物房。将大鼠称重,按随机数字表法分为4组,每组10只。 A组(对照组):以生理盐水代替卵清蛋白(ovalbumin,OVA)致敏和激发大鼠;B组(AR组):以OVA致敏和激发大鼠,鼻腔滴入磷酸盐缓冲液(PBS);C组(布地奈德组):以OVA致敏和激发大鼠,鼻腔滴入布地奈德;D组(IFN-γ组):以OVA致敏和激发大鼠,鼻腔滴入IFN-γ。
1.2 主要试剂及仪器主要试剂有大鼠重组IFN-γ(R&D,美国),OVA干粉剂(5级,Sigma公司,美国),氢氧化铝粉剂(Sigma公司,美国),红细胞裂解液(北京天根生物科技有限公司),percoll细胞分离液(瑞典Pharmacia公司),Wright—Giemsa染液(北京赛驰生物科技有限公司),大鼠Eotaxin酶联免疫吸附试验(ELISA)试剂盒(上海西唐生物科技有限公司),Annexin V/PI凋亡试剂检测盒(碧云天生物科技有限公司),布地奈德鼻喷雾剂(阿斯利康公司,CN52-352B-4745,1.28 μg/μL)。仪器有荧光显微镜(Olympus公司,日本),流式细胞仪(B&D公司,美国)。
1.3 AR大鼠模型的建立造模方法参考文献[1],B、C和D组大鼠均以OVA为变应原,激发典型的AR症状和体征,A组以生理盐水代替OVA。
1.4 实验方法及给药途径A组不作任何处理,作为对照组,第31~38天在OVA激发前30 min B组鼻腔内滴入PBS,每只每侧各50 μL,每日1次;C组鼻腔内滴入布地奈德,每只每侧各50 μL(1.28 μg/μL),每日1次;D组鼻腔内滴入IFN-γ,每只每侧各50 μL (0.02 μg/μL),每日1次。
1.5 鼻腔灌洗液的采集方法参考文献[2],每组每只大鼠每侧鼻腔用无菌生理盐水1.5 mL灌洗,每只大鼠共回收鼻腔灌洗液约2.8 mL。离心(3 000 r/min,15~20 cm),沉淀物涂片,固定后常规瑞士染色,进行细胞分类,计数白细胞总数、EOS数目百分比。
1.6 EOS分离操作方法参考文献[3],鼻腔灌洗液取材后在1 h内行EOS分离,然后行流式细胞术分析。
EOS凋亡率的计算方法:
| ${{早期 {\rm{EOS}} 凋亡数} \over {{\rm{EOS总数}}}} \times 100\% $ |
采用酶联免疫吸附试验(ELISA)法测定鼻腔灌洗液中Eotaxin水平。严格按ELISA试剂盒说明操作,绘制标准曲线,根据光密度值计算Eotaxin含量。
1.8 统计学处理采用SPSS 17.0软件,行正态分布检验,若方差齐则各组数据采用单因素方差分析(ANOVA),各组间比较采用LSD-t检验;若方差不齐采用Dunnett T3检验。对EOS数目百分比、EOS凋亡率及Eotaxin水平行Pearson直线相关分析,P <0.05认为差异有统计学意义。
2 结 果 2.1 OVA致敏及药物处理后大鼠的行为表现B、C和D组大鼠均激发出典型的AR症状,表现为频繁的搔抓鼻、喷嚏、鼻溢液和觅食行为的改变。经干预后C、D组大鼠上述症状均明显减轻,A组除偶有喷嚏及搔鼻外,无特殊反应。
2.2 对鼻腔灌洗液中EOS数目百分比的影响B组大鼠鼻腔灌洗液中白细胞总数、EOS数目百分比均显著增高,与A组比较差异有统计学意义(t=17.26,21.07,P <0.01); C、D组白细胞总数均显著下降,与B组比较差异有统计学意义(t=13.56,31.39,P <0.01);C、D组EOS数目百分比均显著下降,与B组比较差异有统计学意义(t=29.89,20.23,P <0.01),见表 1。
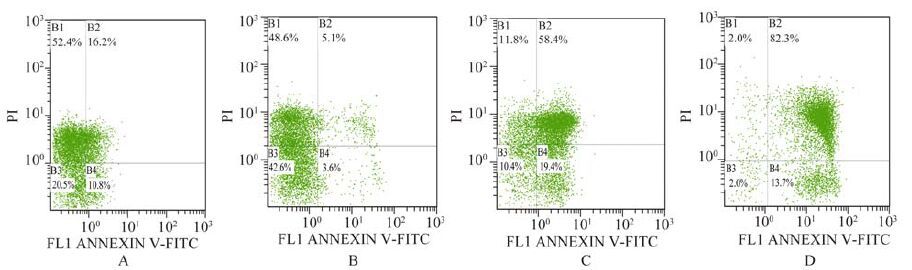
2.3 对鼻腔灌洗液中EOS凋亡率的影响流式细胞图中B4象限即FITC+/PI-,代表早期凋亡细胞,见图 1A-D组。为了避免假阳性,将细胞早期凋亡率作为E0S凋亡率进行统计学分析。B组EOS凋亡率明显降低,与A组比较差异有统计学意义(t=21.14,P <0.01); C、D组EOS凋亡率则显著增高,与B组比较差异有统计学意义(t=21.05,22.83,P <0.01),见表 1、图 1。
| 表 1 IFN-γ对AR大鼠鼻腔灌洗液嗜酸粒细胞凋亡和Eotaxin水平的影响(x±s) Table 1 The apoptosis rate of Eosinophils and Eotaxin levels in the nasal lavage fluid after treatment by IFN-γ(x±s) |
|
图 1 各组大鼠鼻腔灌洗液中EOS凋亡率 Figure 1 The eosinophils apoptotic ratios of nasal lavage fluid of each group |
B、C及D组大鼠鼻腔灌洗液中EOS百分比与其凋亡率均呈负相关关系(r值分别为-0.820,-0.808,-0.769,P均 <0.05)。B、C及D组大鼠鼻腔灌洗液中EOS百分比与Eotaxin水平均呈正相关关系(r值分别为0.816,0.851,0.750,P值均 <0.05)。
3 讨 论机体接触变应原后,EOS 经过聚集、活化以及释放高毒性阳离子蛋白,引起鼻黏膜上皮细胞的损害,从而导致了AR发生[4-5]。细胞凋亡即程序性细胞死亡是细胞在内源性基因的调控下发生的自然或生理性死亡的过程,EOS凋亡可能是调控致敏抗原暴露下的季节性AR患者急性嗜酸性炎症反应的重要机制[6]。已有研究证实,EOS聚集增加和凋亡延迟是肺内EOS 浸润的重要因素,减少肺内EOS的浸润以及促进EOS凋亡能有助于缓解哮喘气道的炎症反应[7]。我们前期的研究发现,鼻腔吸入IFN-γ可以抑制EOS在AR大鼠鼻黏膜中的浸润,并能抑制Th2细胞因子IL-4、IL-5的合成,其作用机制可能是IFN-γ通过阻断GATA3表达抑制IL-5的合成进而抑制了EOS的募集[1]。Eotaxin 是CC 趋化因子家族成员之一,是目前惟一能与CC 趋化因子3 受体(CC chemokine receptor 3,CCR3)特异性结合的趋化因子,对EOS具有强大的特异性的趋化作用,在过敏性炎症反应中Eotaxin能特异性地募集、趋化和激活EOS,引起其浸润、黏附和聚集[8-9]。燕志强等[10]研究发现,Eotaxin在AR豚鼠鼻黏膜中的表达呈显著增强,并与EOS在鼻黏膜局部的浸润和活化有明显相关性 。
本实验结果显示,D组大鼠鼻腔灌洗液中EOS百分比与B组比较明显减少,Eotaxin水平也明显下降,表明IFN-γ能显著减少AR大鼠鼻腔灌洗液中EOS的数量,降低EOS在鼻腔局部的浸润,从而能显著改善AR的症状。本实验结果还显示,IFN-γ具有促进AR大鼠EOS凋亡的作用,EOS凋亡增加能够大大改善鼻腔炎症,明显缓解AR的炎症反应。
另外,本实验结果还表明,B、C及D组大鼠鼻腔灌洗液中EOS百分比与其凋亡率呈负相关关系,EOS百分比与Eotaxin含量呈正相关关系,且有统计学意义。由此可见IFN-γ不仅能明显减少AR大鼠鼻腔内EOS的浸润,而且能显著增加EOS凋亡率,同时显著降低Eotaxin水平,进而减轻AR的症状,从而达到治疗AR的目的。
目前鼻用糖皮质激素已成为ARIA指南的一线用药[11-12],布地奈德是一种作用较强的糖皮质激素,能增加EOS凋亡率,并能抑制EOS的浸润[3]。本实验结果显示,IFN-γ对AR有着与布地奈德相似的作用。当然,IFN-γ对AR的作用机制是多方面的,本实验只是从影响EOS凋亡及Eotaxin水平方面探讨了IFN-γ的作用机制,很多机制还有待于进一步探讨和完善。
| [1] |
李钦, 张永东, 孙崇伟, 等.
鼻腔吸入γ干扰素对大鼠变应性鼻炎的治疗作用[J]. 中华耳鼻咽喉头颈外科杂志 , 2008, 43 (2) : 134–138.
LI Qin, ZHANG Yongdong, SUN Chongwei, et al. Treatment of allergic rhinitis rats by intranasal interferon gamma[J]. Chin J Otorhinolaryngol Head Neck Surgery , 2008, 43 (2) : 134–138. (  0) 0)
|
| [2] |
李钦, 李玉芬, 陈彦林, 等.
白细胞介素5和13受体对变应性鼻炎大鼠血管细胞黏附分子1及γ干扰素的影响[J]. 中华耳鼻咽喉头颈外科杂志 , 2012, 47 (8) : 638–641.
LI Qin, LI Yufen, CHEN Yanlin, et al. Effect of combined use of sIL-5Rα and sIL-13Rα2 on VCAM-1 and IFN-γ in allergic rhinitis rats[J]. Chin J Otorhinolaryngol Head Neck Surgery , 2012, 47 (8) : 638–641. (  0) 0)
|
| [3] |
庄晓艳, 李钦, 陈彦林, 等.
布地奈德对变应性鼻炎大鼠鼻腔灌洗液中嗜酸性粒细胞凋亡的影响[J]. 山东大学耳鼻喉眼学报 , 2014, 28 (2) : 68–71.
ZHUANG Xiaoyan, LI Qin, CHEN Yanlin, et al. Effects of budesonide on eosinophil apoptosis in nasal lavage fluid of allergic rhinitis rats[J]. J Otolaryngol Ophthalmol Shandong Univ , 2014, 28 (2) : 68–71. (  0) 0)
|
| [4] |
Peric' A, Vojvodic' D, Vukomanovic'- D-urevic' B, et al.
Eosinophilic inflammation in allergic rhinitis and nasal polyposis[J]. Arh Hig Rada Toksiko , 2011, 62 (4) : 341–348.
( 0) 0)
|
| [5] |
Cheng K J, Xu Y Y, Liu H Y, et al.
Serum eosinophil cationic protein level in Chinese subjects with nonallergic and local allergic rhinitis and its relation to the severity of disease[J]. Am J Rhinol Allergy , 2013, 27 (1) : 8–12.
DOI:10.2500/ajra.2013.27.3845 ( 0) 0)
|
| [6] |
Foresi A, Teodoro C, Leone C, et al.
Eosinophil apoptosis in induced sputum from patients with seasonal allergic rhinitis and with asymptomatic and symptomatic asthma[J]. Ann Allergy Asthma Immunol , 2000, 84 (4) : 411–416.
DOI:10.1016/S1081-1206(10)62274-0 ( 0) 0)
|
| [7] |
Maskrey B H, Megson I L, Whitfield P D, et al.
Mechanisms of resolution of inflammation: a focus on cardiovascular disease[J]. Arterioscler Thromb Vasc Biol , 2011, 31 (5) : 1001–1006.
DOI:10.1161/ATVBAHA.110.213850 ( 0) 0)
|
| [8] |
Fujisawa T, Kato Y, Nagase H, et al.
Chemokines induce eosinophil degranulation through CCR-3[J]. J Allergy Clin Immunol , 2000, 106 (3) : 507–513.
DOI:10.1067/mai.2000.108311 ( 0) 0)
|
| [9] |
Menzies-Gow A, Robinson D S.
Eosinophil chemokines and chemokine receptors: their role in eosinophil accumulation and activation in asthma and potential as therapeutic targets[J]. J Asthma , 2001, 38 (8) : 605–613.
DOI:10.1081/JAS-100107538 ( 0) 0)
|
| [10] |
燕志强, 章如新, 余少卿, 等.
嗜酸细胞活化趋化因子在变应性鼻炎中的作用[J]. 中国耳鼻咽喉头颈外科杂志 , 2008, 15 (5) : 262–266.
YAN Zhiqiang, ZHANG Ruxin, YU Shaoqin, et al. Role of eotaxin in allergic rhinitis[J]. Chin Arch Otolaryngol Head Neck Surgery , 2008, 15 (5) : 262–266. (  0) 0)
|
| [11] |
Bousquet J, Khaltaev N, Cruz A A, et al.
Allergic rhinitis and its impact on asthma(ARIA)2008 update(in collaboration with the World Health Organization,GA2LEN and AllerGen)[J]. Allergy , 2008, 63 (1) : 8–160.
( 0) 0)
|
| [12] |
Brozek J L, Bousquet J, Baena-Cagnani C E, et al.
Allergic rhinitis and its impact on asthma(ARIA)guidelines:2010 revision[J]. J Allergy Clin Immunol , 2010, 126 (3) : 466–476.
DOI:10.1016/j.jaci.2010.06.047 ( 0) 0)
|
 2016, Vol. 30
2016, Vol. 30

