2. 宁德市医院病理科,福建 宁德 352100 ;
3. 福建医科大学附属第一医院耳鼻喉科,福建 福州 350004
2. Department of Pathology, Ningde Municipal Hospital, Ningde 352100, Fujian, China ;
3. Department of Otorhinolaryngology, First Affiliated Hospital of Fujian Medical University, Fuzhou 350004, Fujian, China
喉癌是常见上皮来源恶性肿瘤,约占头颈部肿瘤的2%,其中约60%为声门型喉癌,因声门区缺乏相应的淋巴组织,使其具有独特的肿瘤学及转移特征,极少发生邻近区域及远处淋巴转移[1]。早期声门型喉癌治疗方式多样,但在保证患者生存率的基础上提高喉部保存率已成为业内共识。当前CO2激光术式渐趋主流即得益于其能完整切除肿瘤并可最大程度地保留喉结构和功能,提高患者生存质量。大量研究表明[2-3],CO2激光与传统术式治疗早期声门型喉癌,术后3年局部复发率及生存率差异无统计学意义。尤其近年来随着显微外科技术的进步及手术器械的改良,CO2激光治疗早期喉癌获得长足进步,其优势获得临床普遍认可。我们在前期研究的基础上对经CO2激光治疗的26例累及前联合的早期声门型喉癌患者的标本行病理研究,术后严格追踪随访,并行统计学处理分析,探讨该术式的临床疗效及安全性。
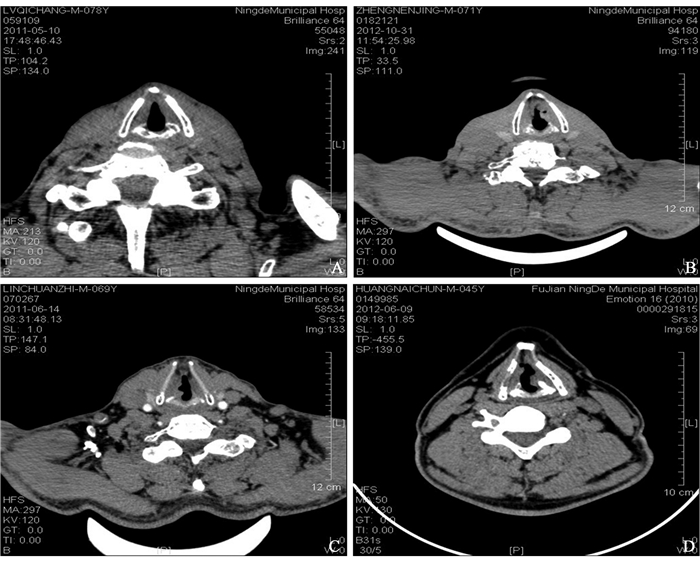
1 资料与方法 1.1 一般资料2008年1月至2012年12月,我们采用CO2激光治疗、有效随访3年且资料完整的侵犯前联合的早期声门型喉癌(图 1)患者26例,男21例,女5例;45~74岁,平均61岁。据国际抗癌协会(UICC)2002年TNM分期标准明确肿瘤分期,活检证实病理类型。所有病例术前均行电子喉镜、频闪喉镜及喉部增强CT等相关检查,剔除前联合暴露不良、双侧声带膜部前端黏膜波消失、肿瘤已浸润甲状软骨者。患者术前均未接受任何治疗。
|
图 1 累及前联合的早期声门癌薄层CT平扫 A:左侧早期声门癌; B:左侧声门癌,肿物向腔内呈乳头状突起; C:右侧声门癌,累及对侧声带前端; D:左侧声门癌,累及对侧声带前中段。 Figure 1 Early glottis carcinoma with anterior commissure involvemen by thin layer CT scan A: Early glottis carcinoma on the left side; B: Glottis carcinoma on the left side with papillae to the laryngeal cavity; C: Glottis carcinoma on the right side, involving the front of the contralateral vocal cord; D: Glottis carcinoma on the left side, involving the front-central of the contralateral vocal cord. |
手术设备采用CO2激光仪(Lumenis,美国)、显微镜(Lecia,德国)、支撑喉镜及喉显微器械(Karl-Storz系列,德国)。
1.2 手术患者经口气管插管静脉复合麻醉后取仰卧垂头位,经口导入支撑喉镜充分暴露声门及前联合,每例根据TNM分期均严格按照2000年欧洲喉科协会声带切除分型决定激光切除的范围和深度,Ⅰ型:切除声带黏膜上皮层;Ⅱ型:切除至声带浅固有层,保留声韧带;Ⅲ型:切除至声韧带;Ⅳ型:声带全切除。所有病例均在激光指示斑引导下距肿瘤外缘2 mm整块切除,前联合前缘均切至甲状软骨内膜。激光输出功率3 W。
1.3 病理分析手术外切缘行术中冰冻病理检查,回报阴性则手术结束,阳性则继续扩大切除至外缘阴性。标本切缘标记后固定、常规包埋、连续切片,层厚4 μm,HE染色镜下观察。
1.4 随访术后每个月复查电子喉镜,半年后每3个月复查,1年半后至少每半年复查1次至今,有效随访3年以上。术后均未行放化疗。
1.5 统计学处理采用SPSS 20.0软件,局部复发率采用直接法计算,组间采用Fisher确切概率法比较,检验水准α=0.05, P<0.05为差异有统计学意义。
2 结 果 2.1 镜下病理分析切缘阴性指镜下未见肿瘤细胞,切缘阳性指镜下可见肿瘤残留。本研究中26例外切缘术中冰冻回报均为阴性(其中包括首次冰冻阳性补切至阴性5例)。术后镜下病理观察结果:可见标本切缘激光烧灼后的坏死细胞和变性组织,切缘阴性20例,阳性6例(23.1%)。
2.2 局部复发率26例患者3年随访中局部复发7例,复发率为26.9%(7/26),其中切缘阳性复发率为83.3%(5/6),切缘阴性复发率为10%(2/20),组间差异有统计学意义(P=0.002),见表 1。复发时间分别为6个月内2例,6个月~1年4例,1~2年1例。
| 表 1 切缘与肿瘤复发 Table 1 Surgical margins and tumor recurrence |
随访中局部和/或区域复发者7例,均及时根据复发肿瘤侵犯范围实施挽救治疗:再次行激光切除手术2例;行喉扩大垂直部分切除或额侧切除加功能性颈淋巴结清扫术4例;因肿瘤侵犯广泛,行全喉切除1例。术后均无瘤生存至今。
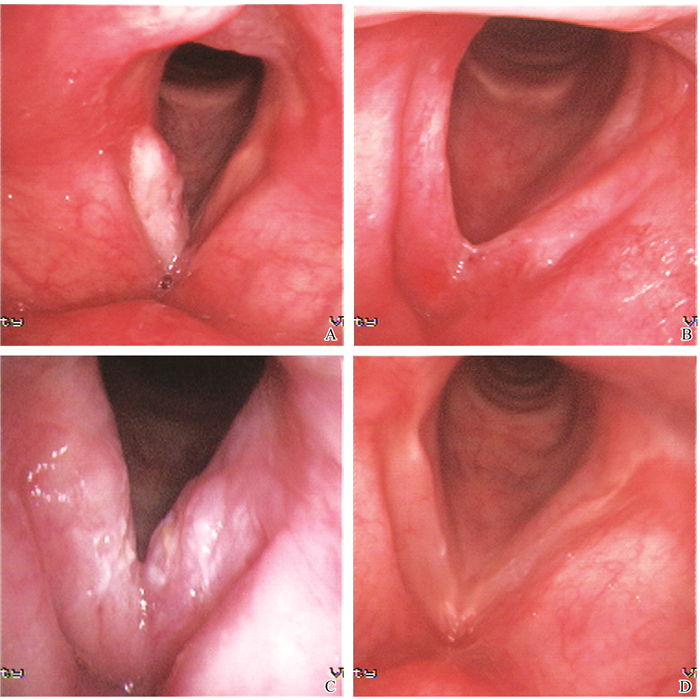
2.4 喉功能保全情况26例首次术中均未行气管切开,术后可正常吞咽、呼吸。术后3~6个月部分出现前联合轻度粘连(图 2),黏膜色泽基本正常,声带稍缩短,声音保留满意;除1例复发行挽救性全喉切除外,均保留了喉的发音功能,满足日常交流需求。
|
图 2 CO2激光治疗累及前联合的T1b期声门型喉的电子喉镜图 A:术前; B:术后6个月,前端局部粘连; C:术前; D:术后6个月。 Figure 2 The figure of CO2 laser microsurgery for T1b staging glottic laryngeal carcinoma with anterior commissure involvement under electronic laryngoscope A: Pre-operation; B: Six months after surgery, adhesion of anterior vocal cords; C: Pre-operation; D: Six months after surgery. |
早期声门癌包括Tis、T1a、T1b及部分T2期,解剖学上定义为局限于声门区而尚未累及周围肌肉和软骨,亦无淋巴结转移[4]。其治疗方式学术界尚存争议,但降低局部复发率同时兼顾喉保存率已达成业内共识。近年来CO2 激光以创伤小、恢复快、喉功能保全好等优点在早期声门型喉癌治疗中已得到广泛应用[5]。在我们的前期报告中[6],CO2激光切除Tis、T1a、T1b及T2声门型喉癌可获得安全切缘,局部控制率及喉功能保全良好,疗效可靠,局部复发病例仍可行挽救手术,无瘤生存率高。但相对于TNM分期,肿瘤实际大小及累及范围对预后的影响更大,所以有学者[7]通过对309例侵及前联合的T1~T4喉癌病例进行研究,结果发现行CO2激光手术者局部复发率与肿瘤的TNM分期无明显相关,而与前联合的受侵范围及程度密切相关,从而提出了“前联合分期”学说;另有研究显示[8],CO2激光治疗早期声门型喉癌的局部复发率为20%,而侵及前联合者为32%。已有的国内外研究报告均提示在早期声门型喉癌的预后因素中,前联合是否受侵是一个重要指标,只要前联合暴露不困难,行CO2激光手术绝非禁忌。即便如此,目前仍缺乏大样本回顾性资料阐述前联合受累与局部复发率的确切关系。
声门型喉癌约有25%累及前联合,缘于肿瘤细胞可黏膜下扩散,许多前联合黏膜肉眼正常而实际已受到侵犯[9]。由于潜在的甲状软骨及会厌前间隙被侵犯可能,且术中完全暴露这些区域难度较大,对于内镜下激光切除一直存在争议。一些学者认为[10-11],只要肿物没有侵犯声门上区,内镜暴露清楚,就可行CO2激光切除,而有学者认为Broyles韧带与甲状软骨仅距2~3 mm且缺乏屏障,肿瘤易穿透软骨造成扩散,是激光术后复发而导致手术失败的重要原因。Rodel等[12]报道前联合受侵和未受侵的5年局部控制率分别为:T1a 73%和89%,T1b 68%和86%,前联合受侵病例复发率高达50%;Steiner等[13]报道激光术后3年生存率与前联合是否受侵无显著关系。本组资料显示侵犯前联合者行激光手术复发率达26.9%,显著高于前期研究中10.4%的总体复发率,也验证了激光治疗早期声门癌的局部控制率与前联合是否受侵有关,具体差异可能源于样本量的大小及设备条件、技术成熟度的差别,鉴于肿瘤侵犯的特点,也不排除某些潜在侵犯的肿瘤被低估了T分期,把事实上已经为T3、T4期的肿瘤归为早期声门型喉癌,从而增加了术后复发率,但确切关系有待大样本资料的长期随访分析来阐明。
生存率与生存质量的兼顾使喉癌手术的安全切缘研究显得尤为重要,国外有学者研究证实CO2激光治疗早期声门癌的安全缘仅需1~2 mm[14]。本课题组前期研究也证实由于激光的热效应及标本弹力纤维回缩,术中实际切缘要大于病理切缘,故术中保留2 mm切缘是可靠的。我们采用术中冰冻检测初步评估切缘情况,对冰冻提示阳性的予扩大切除至阴性为止,向前均切至甲状软骨膜,并对创缘采用激光凝固以期降低阳性切缘的复发率。但由于术中冰冻显示的是外切缘的一个点,且激光烧灼给创缘造成的热损伤,均给术中冰冻检测带来困难,存在一定的假阴性率。本研究中术中切除均至冰冻提示切缘阴性,而连续切片病理观察仍有6例患者存在切缘阳性,在随访过程中切缘阳性的复发率为83.3%(5/6),切缘阴性复发率为10%(2/20),组间差异有统计学意义(P=0.002),提示安全切缘直接影响复发率,切缘阳性意味着肿瘤未有效切除,局部复发率明显增高。而Lee等[15]认为CO2激光治疗的局部控制率、总体生存率及喉功能保存率综合考评优于传统疗法,术中病理切缘阳性并不影响3年无瘤生存率,但术后需密切随访观察。本资料患者术后均制定严格的随访计划,尤其强调术后1年内遵嘱复查,7例局部复发者均及时实施激光或非激光手术的挽救治疗,得到与开放性手术相近的治疗效果,随访至今均无瘤生存,显示CO2激光术后行激光再治疗的安全性及复发后挽救治疗的有效性。
本组资料显示,患者术后创面充血水肿轻微,均未出现喉梗阻,无需行气管切开,部分病例随访中发现前联合轻度粘连,声带稍缩短,但发声功能仍保留较好,喉功能保全明显优于传统喉裂开者,生存质量高,所有患者术后随访≥3年,无瘤生存率较高。CO2激光治疗前联合受累的早期声门型喉癌可最大程度地保存喉功能,优势明显,疗效确切,应用前景广阔。但应严格筛选合适病例,把握手术适应证,以降低局部复发率,提高患者生存率。本研究中我们严格筛选病例,剔除了内镜下前联合暴露不良、术前频闪喉镜明确双侧声带前1/3黏膜波消失、增强CT发现肿瘤已侵达甲状软骨者,但随访3年中复发率仍达26.9%,分析复发病例,可能原因有:支撑喉镜下声门结构的牵拉变形、室带肥厚者镜下易遮盖声门,致术区暴露不充分;存在对肿瘤侵犯深度估计不足及切缘安全性判断不准确可能,复发病例中多有术中出血较多影响视野、麻醉插管遮挡为避免气囊爆燃也可导致切除范围不足、肿瘤残留,且激光烧灼后组织凝固、碳化,增加术中冰冻检出难度。故行CO2激光手术应多点送检冰冻切片以保证安全切缘,避免出现假阴性致安全缘保留不足。激光术后应制定严格的随访方案、延长随访年限,可早期发现局部复发情况并适时采取挽救性治疗及综合干预措施,在保证生存率的基础上最大程度地提高患者生存质量。
| [1] | Grant D G, Repanos C, Malpas G, et al. Transoral laser microsurgery for early laryngeal cancer[J]. Expert Rev Anticancer Ther , 2010, 10 (3) : 331–338. DOI:10.1586/era.10.10 |
| [2] | Mendelsohn A H, Matar N, Bachy V, et al. Longitudinal voice outcomes following advanced CO2 laser cordectomy for glottic cancer[J]. J Voice , 2015, 29 (6) : 772–775. DOI:10.1016/j.jvoice.2014.12.005 |
| [3] | Amir I, Vernham G A. Audit of transoral laser-assisted microsurgical resection of early laryngeal cancer[J]. J Laryngol Otol , 2015, 129 (4) : 372–376. DOI:10.1017/S0022215115000626 |
| [4] | Bahannan A A, Slavicek A, Cerny L, et al. Effectiveness of transoral laser microsurgery for precancerous lesions and early glottis cancer guided by analysis of voice quality[J]. Head Neck , 2014, 36 (6) : 763–767. DOI:10.1002/hed.v36.6 |
| [5] | Mendelsohn A H, Xuan Y, Zhang Z. Voice outcomes following laser cordectomy for early glotticcancer: aphysical model investigation[J]. Laryngoscope , 2014, 124 (8) : 1882–1886. DOI:10.1002/lary.v124.8 |
| [6] |
宁佳羽, 朱忠寿, 林昶, 等.
CO2激光治疗早期声门型喉癌的临床研究[J]. 肿瘤研究与临床 , 2015, 27 (11) : 763–765.
NING Jiayu, ZHU Zhongshou, LIN Chang, et al. Clinical study on CO2 laser microsurgery for early glottic laryngeal carcinoma[J]. Cancer Research and Clinic , 2015, 27 (11) : 763–765. |
| [7] | Rucci L, Romagnoli P, Scala J. CO2 laser therapy in Tis an T1 glotticcancer:indicationsand results[J]. Head Neck , 2010, 32 (3) : 392–398. |
| [8] | Mortuaire G, Francois J, Wiel E, et al. Local recurrence after CO2 laser cordectomy for early glottic carcinoma[J]. Laryngoscope , 2006, 116 (1) : 101–105. DOI:10.1097/01.mlg.0000184524.23282.74 |
| [9] | Bertino G, Degiorgi G, Tinelli C, et al. CO2 laser cordectomy for T1-T2 glottic cancer: oncological and functional long-term results[J]. Eur Arch Otorhinolaryngol , 2015, 272 (9) : 2389–2395. DOI:10.1007/s00405-015-3629-2 |
| [10] | Mizrachi A, Rabinovics N, Hilly O, et al. Analysis of failure following transoral laser surgery for early glotticcancer[J]. Eur Arch Otorhinolaryngol , 2014, 271 (8) : 2247–2251. DOI:10.1007/s00405-014-2964-z |
| [11] | Sachse F, Stoll W, Rudack C. Evaluation of treatment results with regard to initial anterior commissure involvement in early glottic carcinomatreated by external partial surgery or transoral laser microresection[J]. Head Neck , 2009, 31 (4) : 531–537. DOI:10.1002/hed.v31:4 |
| [12] | Rodel R M, Steiner W, Muller R M, et al. Endoscopic laser surgery of early glotticcancer: involvement of the anterior commissure[J]. Head Neck , 2009, 31 (5) : 583–592. DOI:10.1002/hed.v31:5 |
| [13] | Steiner W, Ambrosch P, Rodel R M, et al. Impact of anterior commissure involvement on local control of early glottic carcinoma treated by laser microresection[J]. Laryngoscope , 2004, 114 (8) : 1485–1491. DOI:10.1097/00005537-200408000-00031 |
| [14] | Michel J, Fakhry N, Duflo S, et al. Prognostic value of the status of resection margins after endoscopic laser cordectomy for T1aglottic carcinoma[J]. Eur Ann Otorhinolaryngol Head Neck Dis , 2011, 128 (6) : 297–300. DOI:10.1016/j.anorl.2011.05.006 |
| [15] | Lee H S, Chun B G, Kim S W, et al. Transoral laser microsurgery for early glottic cancer as one-stage single-modality therapy[J]. Laryngoscope , 2013, 123 (11) : 2670–2674. DOI:10.1002/lary.v123.11 |
 2016, Vol. 30
2016, Vol. 30

