2. 山东大学齐鲁医院眼科 ;
3. 山东大学医学院生理学教研室,山东 济南 250012
2. Department of Ophthalmology, Qilu Hospital of Shandong University ;
3. Department of Physiology, School of Medicine, Shandong University, Jinan 250012, Shandong, China
阔筋膜为股部的深筋膜,其组织结构致密坚韧,作为术中修复材料被广泛应用于矫正中、重度上睑下垂[1-4]等外科手术,并取得良好效果。目前,临床应用的阔筋膜主要是来源于捐献者的同种异体阔筋膜。作为异体材料,取材后选择何种保存方法,更好地保留阔筋膜细胞外基质的完整性和生物力学性能的有效性尚无明确定论。本研究以新鲜阔筋膜为对照,对临床上使用的梯度乙醇固定保存、深低温甘油保存[5]及复合抗生素溶液浅低温保存[6]三种方法进行比较, 为临床上异体阔筋膜保存方案的选择提供依据。
1 材料与方法 1.1 材料 1.1.1 同种异体阔筋膜取自2013年10月至2014年10月在山东大学齐鲁医院死亡后6 h之内的无感染性疾病和恶性肿瘤的新鲜供体。本研究经山东大学齐鲁医院伦理委员会批准,研究过程中严格遵循医院伦理委员会的管理要求。
1.1.2 其他无菌盐水, 乳酸钠林格注射液, 头孢唑林钠粉剂, 硫酸庆大霉素注射液, 氯霉素注射液, 妥布霉素注射液, 75%乙醇, 95%乙醇, 灭菌甘油, 均为临床使用品。
1.2 方法 1.2.1 同种异体阔筋膜取材用消毒液充分消毒大腿外侧皮肤,切开皮肤,逐层分离至脂肪层,拉钩拉开切缘,充分暴露银白色的阔筋膜,仔细剥离并取下整块阔筋膜,用无菌盐水纱布包裹,低温保存。
1.2.2 阔筋膜抗原成分的去除按照无菌操作原则铺设无菌手术操作台,操作人员穿无菌手术衣戴无菌手套,将未去除抗原成分的异体阔筋膜(图 1A)用乳酸钠林格注射液冲洗,洗净表面碎屑。肉眼下大体去除阔筋膜表面皮下组织及脂肪组织,然后移至手术显微镜下,按照阔筋膜纤维走向仔细剥除阔筋膜表面多余组织,直至显微镜下不能观察到阔筋膜表面任何组织残留(图 1B)。然后按临床需要将其修剪成60 mm×10 mm大小的阔筋膜条。用含1%头孢唑林钠和1 000 U/mL硫酸庆大霉素的乳酸钠林格注射液分别浸泡洗涤15 min,再用不含抗生素的乳酸钠林格注射液反复漂洗,直至无药液残留。将阔筋膜用灭菌注射用水反复冲洗,并置于灭菌注射用水中浸泡24 h,其间放于4 ℃冰箱中,然后移入另一灭菌注射用水容器中再次浸泡24 h,再用乳酸钠林格注射液冲洗至少3次。

|
图 1 新鲜阔筋膜 A:未去除抗原;B:去除抗原。 Figure 1 Fresh broad fascia A:Before removing antigen;B:After removing Antigen. |
①梯度乙醇固定保存:将制备完成的阔筋膜置于75%乙醇中浸泡24 h,然后移入95%乙醇中,置于4 ℃恒温冰箱中保存,每周更换95%乙醇和容器一次;②深低温甘油保存:制备完成的阔筋膜放入灭菌甘油瓶中脱水,4 ℃恒温冰箱保存,24 h后移入另一无菌甘油瓶中,置于低温冰箱-80 ℃保存;③复合抗生素溶液浅低温保存:将制备完成的阔筋膜放入含0.12%氯霉素及0.15%妥布霉素混合溶液的无菌小瓶中密封,并置于-20 ℃低温冰箱中冷冻保存,每隔1个月更换保存液和容器一次。
1.3 检测 1.3.1 理化特性检测分别取不同方法保存1个月、3个月及6个月的去抗原异体阔筋膜标本进行物理学观察、微生物检测和组织结构观察,并与新鲜阔筋膜进行比较。
1.3.2 生物力学性能检测将不同方法保存6个月的去抗原异体阔筋膜标本制成相同规格大小,分别用TSKT-200A微机控制生物力学测试仪(济南时代新光仪器有限公司)作拉力测试。测试前设置试验速度10 mm/min,标距20 mm(图 2A)。试样拉断后测试结束(图 2B),试验数据自动保存,每组取6个样本的平均数进行统计学分析。

|
图 2 生物力学测试 A:测试前;B:测试后。 Figure 2 Biomechanical test A:Before test;B:After test. |
采用SPSS 13.0 软件,数据以x±s表示,组间比较采用单因素方差分析。检验水准α=0.05, P<0.05为差异有统计学意义。
2 结 果 2.1 三种方法保存的同种异体阔筋膜理化特性分析 2.1.1 物理学对照新鲜去抗原同种异体阔筋膜色泽鲜亮,呈银白色(图 1B),为一致密膜状结构,厚度0.5~0.7 mm,含水,质地柔韧,弹性好。三种方法保存的异体阔筋膜经复水后观察,梯度乙醇固定保存至6个月时,阔筋膜色泽减退,颜色呈淡黄色,柔韧性降低;深低温甘油保存和复合抗生素溶液浅低温保存的阔筋膜与新鲜阔筋膜相比,无明显改变。
2.1.2 无菌状态检测对保存不同时间点获取的阔筋膜标本进行细菌、真菌培养,检测结果均为阴性。
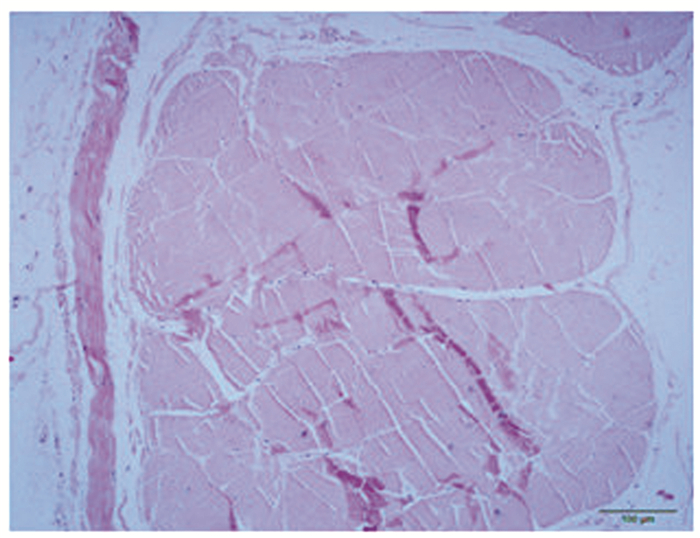
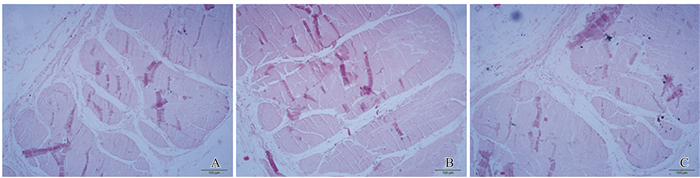
2.1.3 组织结构观察新鲜阔筋膜HE染色结果可见三层结构:内层和外层是横向纤维层,可见较多横向排列的胶原纤维和弹力纤维,中间层是厚而强韧的纵向纤维,纤维排列非常致密(图 3)。梯度乙醇固定保存的阔筋膜随着保存时间的延长,纤维排列密度逐渐降低(图 4);深低温甘油和复合抗生素溶液浅低温保存的阔筋膜与新鲜阔筋膜比较无明显改变(图 5、6)。
|
图 3 新鲜阔筋膜组织形态(HE,×100) Figure 3 Morphology of fresh broad fascia(HE,×100) |

|
图 4 梯度乙醇固定保存阔筋膜组织形态(HE,×100) A:1个月;B:3个月;C:6个月。 Figure 4 Morphology of broad fascia preserved in gradient alcohol (HE,×100) A:1 month;B:3 months;C:6 months. |
|
图 5 深低温甘油保存阔筋膜组织形态(HE,×100) A:1个月;B:3个月;C:6个月。 Figure 5 Morphology of broad fascia preserved in glycerin under deep low temperature (HE,×100) A:1 month;B:3 months;C:6 months. |

|
图 6 复合抗生素溶液浅低温保存阔筋膜组织形态(HE,×100) A:1个月;B:3个月;C:6个月。 Figure 6 Morphology of broad fascia preserved in composite antibiotics solution under mildly low temperature (HE,×100) A:1 month;B:3 months;C:6 months. |
单因素方差分析结果显示,四组阔筋膜生物力学性能比较,总体无统计学差异,说明保存的阔筋膜在最大载荷、抗拉强度和断裂伸长率方面与新鲜阔筋膜没有明显差异。见表 1。
| 表 1 各组阔筋膜生物力学性能比较(x±s) Table 1 Biomechanical performance of broad fascia among the 4 groups (x±s) |
临床应用的阔筋膜依据来源不同分为自体阔筋膜和同种异体阔筋膜。自体阔筋膜为患者的自身组织,取材后会对患者造成医源性创伤,增加患者痛苦,且取材量受限;同种异体阔筋膜来源于供体,通过科学、规范的去抗原处理,具有组织免疫反应轻微、材料质地良好、移植后不易被人体吸收等特点,不仅可以得到与宿主自身特征相似的筋膜组织,而且无自身筋膜组织采集相关的并发症[7],作为一种天然的生物材料在临床上得到广泛应用。
细胞外基质是指位于上皮或内皮细胞下层、结缔组织细胞周围,为组织、器官甚至整个机体提供力学支持和物理强度的物质[8]。阔筋膜细胞外基质是一种由胶原纤维、弹力纤维、基质和少量细胞组成的致密结缔组织[4],具有支持、连接、抗压、保护等生物学作用,其强韧的纵行纤维层与受力方向一致,与横行纤维层交错构成的紧密结构使其具有很强的抗拉伸性能。本研究在同种异体阔筋膜处理时采用物理法联合渗透溶液法,在充分去除可见抗原后再利用渗透压的变化使残存细胞的细胞膜破裂,使细胞从基质中分离,有效去除了异体阔筋膜的抗原成分;同时研究结果显示,保持阔筋膜抗拉伸性能的三层结构在三种方法保存的阔筋膜中均可见到,提示这三种保存方法均能在一定程度上保存阔筋膜的结构。与新鲜阔筋膜相比,只有梯度乙醇固定保存的阔筋膜保存至6个月时,阔筋膜理化特性发生了一定程度的改变,但其基本结构仍然清晰。我们认为,虽然乙醇使组织脱水、脱色且对其有固定作用,但由于阔筋膜主要由成纤维细胞构成,密集的胶原纤维维持了其组织学形态。深低温甘油和复合抗生素溶液浅低温保存方法能较好地保留阔筋膜细胞外基质的完整性。
阔筋膜在临床上作为修复材料,必须要考虑的力学性能主要是其强度和柔韧性。强度即要求阔筋膜要有足够的强度以承受缝合力和在手术部位一定时期内维持局部组织形态以帮助组织再生;柔韧性即能够随组织活动时弯曲和生长时扩张面有一定的弹性[9]。阔筋膜的生物力学性能对于手术效果,尤其是远期疗效至关重要。由表 1可以看出,以上三种方法保存的阔筋膜生物力学性能与新鲜阔筋膜无统计学差异。由此可见,三种保存方法未破坏保存阔筋膜的组织结构,其生物力学性能未因保存时间的延长而发生改变。研究发现,组织细胞在快速冷冻过程中,细胞内部的水分子来不及渗透到细胞外而在细胞内形成冰晶,损伤细胞结构[10]。阔筋膜的三种保存方法,虽然生物力学性能与新鲜阔筋膜比较无统计学差异,但在超微结构上,保存液的性质对组织细胞的作用也值得重视。就保存液而言,甘油作为渗透性抗冻保护剂[11],可以迅速透过细胞膜,与细胞内水分互溶,有利于保持细胞内成分,稳定渗透压,在冷冻和复温过程中起到有效防止细胞脱水、冰晶形成的作用,避免细胞受到化学性和机械性损伤,同时甘油对微生物还有杀灭作用;梯度乙醇可消毒和防腐,使蛋白质凝固变性,是无活性保存液;复合抗菌素溶液低温保存时,抗生素在有效浓度内既能杀灭细菌,也会对正常细胞产生毒副作用。由此可见,甘油是对组织细胞最安全、有效的保存液。
由于医疗需求的无限性和医疗资源的有限性矛盾日益突出,最优化技术越发受到管理者的关注。三种方法保存的同种异体阔筋膜在临床使用前需要经过解冻、复水、消毒、冲洗等工序,工作量相差不大;但在保存过程中,由于保存方式的不同,为了保持阔筋膜的生物特性,需要做的工作简繁有别。乙醇固定保存方法每周需消毒保存容器并更换保存容器和保存液;复合抗生素溶液浅低温保存方法每月需要先解冻,然后再更换保存容器和保存液;深低温甘油保存方法在保存过程中不需要任何操作。由此可见,阔筋膜制备完成后,只有深低温甘油保存方法无需再操作,其余两种方法均需要定期更换保存容器和保存液。频繁的操作,在增加工作量同时,也增加阔筋膜变性和污染的风险。
综上所述,三种保存方法在保留异体阔筋膜细胞外基质的完整性、生物力学性能的有效性和临床应用的简便性方面各有不同的时效和特点。在临床应用时,应根据材料的数量、保存时间的实际需求和现有的仪器设备,选择最适宜的保存方案。深低温甘油保存简单、实用、安全、可靠,适合于材料来源丰富时,一次多量取材,去抗原处理后长期保存备用;梯度乙醇固定和复合抗生素溶液浅低温浸泡更适合于较短时间内的保存。
| [1] |
董丽, 陈学英, 张育敏, 等.
同种阔筋膜临床应用研究进展[J]. 中国修复重建外科杂志 , 2012, 26 (7) : 880–883.
DONG Li, CHEN Xueying, ZHANG Yumin, et al. Progress in research of clinical applications of fascia lata allograft[J]. Chinese Journal of Reparative and Reconstructive Surgery , 2012, 26 (7) : 880–883. |
| [2] | 石洵, 夏海涛, 江燕. 阔筋膜悬吊术治疗先天性上睑下垂[J]. 中国斜视与小儿眼科杂志 , 2000, 8 (3) : 123–125. |
| [3] |
陈忠飞, 徐深, 李京, 等.
阔筋膜悬吊术治疗儿童重度先天性上睑下垂[J]. 中国斜视与小儿眼科杂志 , 2007, 15 (4) : 166–168.
CHEN Zhongfei, XU Shen, LI Jing, et al. Banked fascia flap suspension surgery for Children's severe congenital blepharoptosis[J]. Chinese Journal of Strabismus and Pediatric Ophthalmology , 2007, 15 (4) : 166–168. |
| [4] | 韩高安, 徐乃江. 同种异体阔筋膜在眼科的应用[J]. 眼科新进展 , 1995, 15 (1) : 54–55. |
| [5] | 杜春光, 闫明, 王洋, 等. 长期甘油保存阔筋膜治疗上睑下垂[J]. 眼科新进展 , 2000, 20 (6) : 439–441. |
| [6] | 袁建树, 吴国海, 周雨声, 等. 异体阔筋膜浅低温长期保存方法及在眼部整形中的应用[J]. 中国实用眼科杂志 , 2001, 19 (6) : 454–455. |
| [7] |
李冬梅.
生物补片在女性盆底重建应用中的生物相容性[J]. 中国组织工程研究与临床康复 , 2010, 14 (34) : 6421–6424.
LI Dongmei. Biocompatibility of biological patch in female pelvic floor reconstruction[J]. Journal of Clinical Rehabilitative Tissue Engineering Research , 2010, 14 (34) : 6421–6424. |
| [8] | 成军. 细胞外基质的分子生物学与临床疾病[M]. 北京: 北京医科大学出版社, 1999 : 10 -28. |
| [9] |
刘彬, 蔡绍皙, 徐志强, 等.
几种神经支架原材料的生物力学性质评价[J]. 现代生物医学进展 , 2006, 6 (11) : 22–23.
LIU Bin, CAI Shaoxi, XU Zhiqiang, et al. Evaluations of biomechanical property of nerve scaffold materials[J]. Progress in Modern Biomedicine , 2006, 6 (11) : 22–23. |
| [10] | 徐帆. HTK液改良液氮深低温保存法对大鼠带瓣管道活性的影响[D].福州:福建医科大学,2012:33. |
| [11] |
马庆.
深低温长期保存红细胞的效果评价[J]. 中国输血杂志 , 2012, 25 (9) : 837–840.
MA Qing. Evaluation of the long-term cryopreservation of red blood cells[J]. China J Blood Transfusion , 2012, 25 (9) : 837–840. |
 2016, Vol. 30
2016, Vol. 30

