甲状腺未分化癌(anaplastic thyroid cancer, ATC)发病率低,仅占甲状腺恶性肿瘤的1%~2%[1],但其死亡率却高达14%~29%[2],是甲状腺癌最主要的死亡原因。其好发于中老年女性,多数患者在确诊后短时间内可出现肿块迅速增大、呼吸困难、吞咽困难、声音嘶哑及远处转移,即使积极治疗,其1年及5年生存率仅分别为28%、5%[3-4]。目前ATC治疗方式主要有手术、放疗、化疗及靶向治疗,但仍缺乏规范且有效的治疗模式,单一的方式往往不能有效控制疾病进展,改善预后。本文就目前临床分期、治疗方式及结合我院诊治情况浅谈ATC“规范化”治疗。
1 临床分期根据国际抗癌联盟(union international control cancer, UICC)和美国肿瘤联合委员会(American joint committee on cancer, AJCC)2012年修订的TNM分期标准[4],所有的ATC属于Ⅳ期,不论原发灶大小、淋巴结转移情况。根据原发灶是否局限在甲状腺内,是否远处转移,又分为ⅣA、ⅣB和ⅣC期。ⅣA期:肿瘤病灶局限在甲状腺内(T4a),N0,M0,无远处转移;ⅣB期:原发肿瘤侵犯到腺体外(T4b),N0-N3, M0; ⅣC期:任何原发灶伴有远处转移。2015年版美国国家综合癌症网(national comprehensive cancer network, NCCN)提出的最新指南[5]中并未对ATC诊治做大量修改,与UICC及AJCC分期标准相似。分类如下:
Stage ⅣA: T4a Any N M0
Stage ⅣB: T4b Any N M0
Stage ⅣC: Any T Any N M1
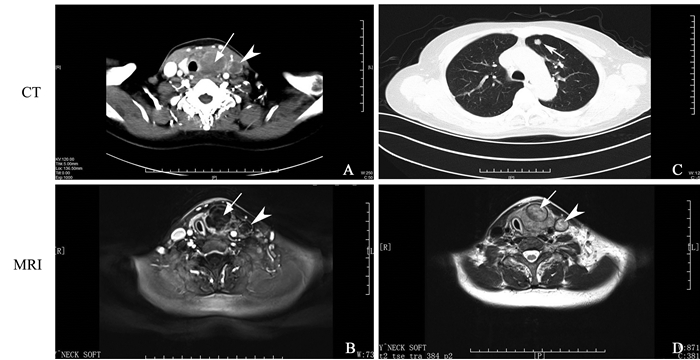
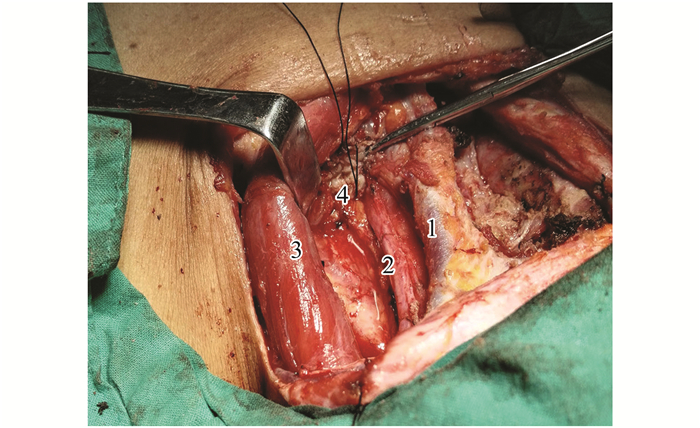
指南[5]建议ⅣA及ⅣB期患者都应积极行双侧甲状腺全切及中央区和颈侧区淋巴结清扫,并且术后积极给予放化疗,以延长患者生存期。但如肿瘤已远处转移,手术治疗仅仅用于解除气管压迫或气管造瘘,活检确诊,对患者长期生存无明显获益。去年我院一例ⅣA患者手术后放疗,12个月后发现肺转移,采用靶向药物治疗维持。另一例ⅣB患者R1手术后1个月复发死亡。近期一例ATC伴左颈静脉、左锁骨下静脉-左头臂静脉交界处癌栓,放弃劈胸,姑息切除甲状腺肿瘤和颈静脉癌栓,见图 1、图 2。
|
图 1 甲状腺未分化癌伴颈静脉侵犯(A/B/D中长箭头为甲状腺未分化癌灶,C中短箭头为肺内可疑转移灶) Figure 1 Anaplastic thyroid carcinoma with jugular vein invasion(long arrow in A, B and D for the undifferentiated thyroid lesions and short arrows in C for suspicious metastases in the lung) |
|
图 2 术中 1:颈前静脉; 2:颈总动脉; 3:胸锁乳突肌; 4:颈内静脉及其癌栓姑息切除后残端。 Figure 2 Intraoperative image 1:Anterior cervical vein; 2: Common carotid artery; 3: Sternocleidomastoid muscle; 4: Internal jugular vein and its thrombus after palliative resection of the stump. |
在确诊ATC后对患者进行预后风险指数评估及风险分组,对于判断ATC的预后及指导临床抉择具有重要意义。Zivaljevic[6]将患者分成 < 50岁,50~70岁, >70岁3组,平均生存期分别为174.3、50.2、30.0周。明确指出年龄是除手术外影响预后的独立因素。研究同样指出>70岁患者与 < 70岁患者在生存期上存在明显差异[7]。此外,尚有人认为,首诊时白细胞数在正常范围,其生存期较长。研究指出白细胞数 < 1.0×1010/L的31例患者生存期为11.3±2.8月,而≥1.0×1010/L患者生存期为3.6±0.7月(P < 0.05)[8];另一研究报道326例白细胞≥1.0×1010/L及181例 < 1.0×1010/L的ATC患者,1年生存率分别为11%和22%(P < 0.001)[9]。另外,肿瘤大小也是影响预后的独立因素,Sugitani等[8]发现,≥5cm肿瘤患者半年及1年生存率分别为30%、14%,而<5cm肿瘤患者半年及1年生存率分别为49%、26%。但淋巴结是否转移及临床病理并不影响患者预后,而存在远处转移则为预后的不利因素[10]。
3 手术治疗大量临床资料表明,手术对于肿瘤的根治程度是预后的一个重要因素[5]。术后病理:显微镜下无肿瘤残留(R0)、显微镜下有肿瘤残留(R1)或肉眼下可见肿瘤残留(R2)皆能影响病人的生存率。
Suqitani等[10]统计233例ⅣB期ATC患者,分别行根治性、治疗性、姑息性手术,术后1年生存率分别为30%、39%、13%。研究显示,临床达到肉眼切除干净患者的5年生存率(41.4%)明显高于肿瘤肉眼残存患者(12.4%)[11]。Pierie等[12]报道的67例ATC患者中44例行手术治疗,完整切除组12例,1年生存率为92%,减瘤手术后1年生存率为35%,而未手术组仅为4%。R0切除生存率明显高于R1及R2。而淋巴结转移对生存率影响较少,AJCC关于ATC分期也是由原发肿瘤和远处转移决定,与淋巴结转移无关。说明手术对于淋巴结处理相对影响较小,但超声提示有淋巴结转移证据时,淋巴结清扫术仍是必要的。
但对于肿瘤累及气管、食管等周围器官或有远处转移的患者,已无手术机会,对此类患者不建议激进的甲状腺手术治疗,因有资料表明扩大手术范围不但不能提高生存时间及生存率,还会增加手术并发症。如出现呼吸道压迫症状可放置支架或预防性气管切开或行靶向药物治疗, 观察肿块是否减小并有根治性手术机会。第3例未分化癌患者,外院细针抽吸活组织检查无法诊断,我院行粗针穿刺确诊,但已出现气管狭窄和呼吸困难,进行支架置放后放疗,3个月后死亡。第4例患者巨大ATC粗针穿刺确诊,未及时住院,呼吸困难死亡。
4 放疗外放疗适用于所有确诊为ATC患者,既是已失去手术机会患者可供选择的主要治疗方式,也是术后主要的辅助治疗手段。放疗与手术相结合才能对ATC达到更好的治疗效果,但二者的先后顺序未有指南明确。Sun等[13]对50例ATC患者以总放射剂量>40Gy(44~78Gy)为高剂量组,≤40Gy(14~38Gy)为低剂量组进行放射治疗,高剂量组及低剂量组患者1年生存率分别为52.2%、34.8%,患者3年生存率分别为24.3%、15.4%,说明放疗剂量>40Gy能显著延长生存期。而对于放射靶区,则主要包括甲状腺床、中央区、双侧颈侧区Ⅰ~Ⅵ及上纵膈Ⅶ区,还包括颅底一些区域[14]。并且为了减少喉、气管、脊髓等重要器官的辐射量,临床上常采用“调强放疗技术”,可保证肿瘤区域比非肿瘤区域高1.8~2.0Gy[15]。此外,Zhou等[16]指出放疗联合光热治疗被证实对肿瘤细胞有较好的杀伤作用,具有广泛的应用前景。我院近期收治的1例ATC患者,穿刺确诊ATC后于2年前行双侧甲状腺切除术,术后3个月,再次发现颈部肿块复发,于我院行肿块切除术加颈部淋巴结清扫术,但术后未行放疗,随访3个月后去世,也进一步说明了放疗作为辅助治疗手段的重要性。近期一例64岁女性,甲状腺5cm肿块伴颈侧区转移,行R0切除,术后1个月颈部扪及2cm肿块,复发;胸部多发转移,目前行放疗和靶向治疗,病情暂时得到控制。
5 化疗ATC对化疗敏感度较低,临床获益较少,相应的化疗药物也较少,可作为手术或者放疗的补充。目前应用于化疗药物主要包括阿霉素、紫杉醇类、博来霉素和多柔比星。阿霉素被普遍认为效果比较确切,常联合顺铂使用[17]。
Lowe等[18]报道19例ATC患者在放疗后使用阿霉素联合顺铂进行化疗,相比于手术及放疗组,中位生存期平均延长220d。这说明化疗在补充手术及放疗治疗效果方面具有一定作用。
在初次化疗的6例患者中使用紫杉醇联合顺铂,剂量为75mg/m2, 6个疗程后,3例患者表现出部分缓解,3例表现为稳定状态,总反应率为50%,白细胞减少发生率为88%[19]。相比于阿霉素联合顺铂的组合,紫杉醇是ATC的另一个合理选择。
6 靶向治疗分子靶向抗癌药物一般作用于肿瘤细胞特定分子靶点, 利用肿瘤细胞与正常细胞在基因、酶、信号转导等方面异常,选择性抑制肿瘤细胞的增殖、侵袭、转移等恶性生物学行为,从而在杀死细胞的同时对正常细胞不良反应较少。目前ATC分子靶向治疗主要以抑制肿瘤新生血管形成及细胞增殖为主。
6.1 酪氨酸激酶抑制剂索拉非尼是一种口服酪氨酸激酶抑制剂,具有双重抗肿瘤作用,一方面结合丝氨酸/苏氨酸蛋白激酶B-raf(BRAF)区域,阻断BRAF信号转导通路;另一方面则阻断新生血管生成。Savvides等[20]报道的临床Ⅱ期研究中,20例患者给药2次/d,每次400mg,治疗取得满意效果。2例患者明显有效,维持时间分别为10、27个月。5例患者疾病保持稳定,中位无病进展期为15.9个月。主要毒性为高血压及皮肤红疹。伊马替尼能在细胞水平上抑制原癌基因蛋白质C-kit和血小板衍化生长因子受体酪氨酸激酶,从而抑制细胞增殖并诱导凋亡。
6.2 抗表皮生长因子受体(epidermal growth factor receptor, EGFR)靶向药物在ATC细胞中EGFR过表达[21], Pennell等[22]报道临床Ⅱ期研究中27例使用吉非替尼的5例ATC晚期甲状腺癌患者,平均肿瘤体积减少32%并且其中1例保持12个月的肿瘤无病进展期。
血管生成抑制剂可选择性破坏现有肿瘤血管,具有抗血管生成的作用。哺乳动物雷帕霉素靶蛋白抑制剂(依维莫司)、BRAF抑制剂(维罗非尼)在延长患者生存期,减少肿瘤大小方面具有较好的效果。
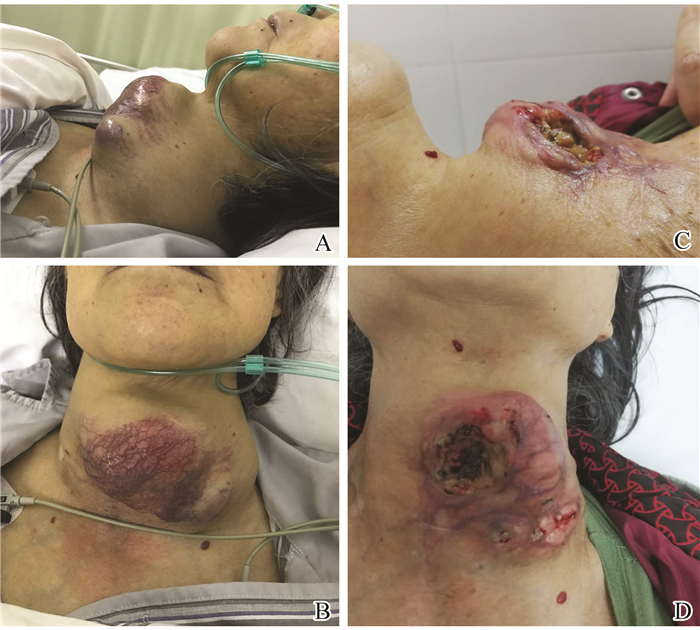
我院收治的1例巨大ATC患者,女,77岁,颈部无痛性肿块伴有声音嘶哑及吞咽梗阻感,肿块大约12cm×7.5cm×5cm,无法进行手术治疗,行国产阿帕替尼靶向治疗后,肿瘤体积逐渐减少,质地变软,自行破溃,提供了进行根治性手术治疗的可能性,见图 3。
|
图 3 靶向药物治疗前后比较 A/B:靶向药物治疗前;C/D:靶向药物治疗后。 Figure 3 Comparison before and after apatinib treatment A/B: Before apatinib treatment; C/D: After apatinib treatment. |
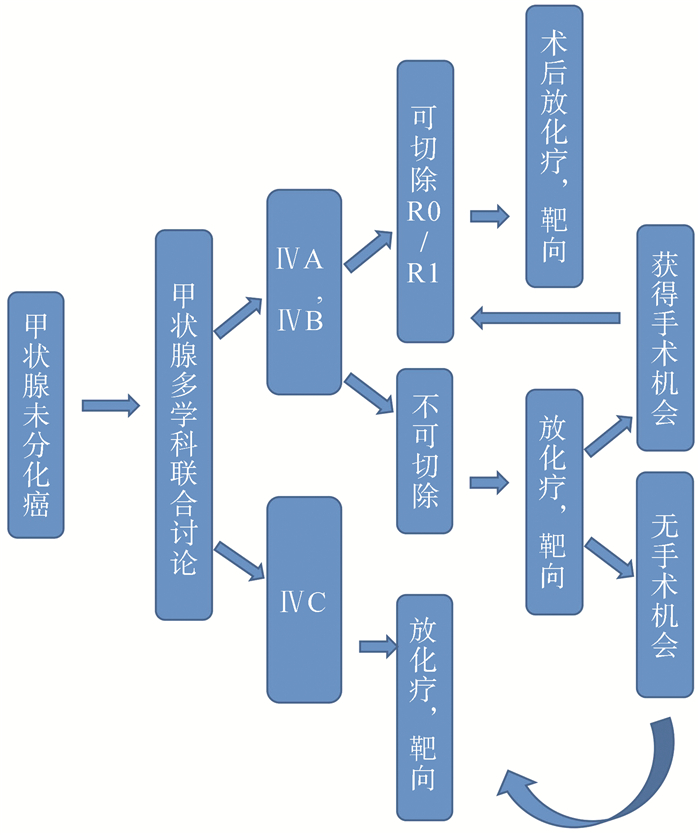
ATC恶性程度较高,进展迅速,预后较差,探索制定较为有效的规范化治疗模式仍有一定意义。图 4为我院结合自身病例针对ATC制定的规范化诊治流程图。对于ATC患者,初步诊断通常是根据患者的临床症状、体征及病变部位生长速度。确诊则要靠粗针穿刺组织学检查或手术活检的病理学诊断,加行免疫组化检查,来与其他疾病相鉴别。确诊后由多学科共同参与讨论,制定治疗方案。若评估为ⅣA、ⅣB患者并且可达到R0/R1切除,则应尽快优先选择手术,术后1个月进行放化疗。肿块较大或不能手术者可先行靶向药物或者放化疗,肿瘤可能进一步减少从而带来手术切除的机会,对于此类患者经过规范的系统治疗仍有较长的生存期。而ⅣC期的患者对传统治疗方法效果较差,多采用姑息治疗,预后往往较差或者行靶向药物控制,提高生活质量。对此规范化治疗流程还需结合更多的多中心临床病例研究进行完善和改进。
|
图 4 甲状腺未分化癌的规范化诊治 Figure 4 Treatment for anaplastic thyroid carcinoma |
| [1] | Kebebew E, Greenspan FS, Clark OH, et al. Anaplastic thyroid carcinoma. Treatment outcome and prognostic factors[J]. Cancer, 2005, 103(7): 1330–1335. DOI:10.1002/cncr.20936 |
| [2] | Wendler J, Kroiss M, Gast K, et al. Clinical presentation, treatment and outcome of anaplastic thyroid carcinoma: results of a multicenter study in germany[J]. Eur J Endocrinol, 2016, 175(6): 521–529. DOI:10.1530/EJE-16-0574 |
| [3] | Segerhammar I, Larsson C, Nilsson IL, et al. Anaplastic carcinoma of the thyroid gland: treatment and outcome over 13 years at one institution[J]. J Surg Oncol, 2012, 106(8): 981–986. DOI:10.1002/jso.23177 |
| [4] | Smallridge RC, Ain KB, Asa SL, et al. American thyroid association guidelines for management of patients with anaplastic thyroid cancer[J]. Thyroid, 2012, 22(11): 1104–1139. DOI:10.1089/thy.2012.0302 |
| [5] | Haddad RI, Lydiatt WM, Ball DW, et al. Anaplastic thyroid carcinoma, version 2.2015[J]. J Natl Compr Canc Netw, 2015, 13(9): 1140–1150. DOI:10.6004/jnccn.2015.0139 |
| [6] | Zivaljevic V, Tausanovic K, Paunovic I, et al. Age as a prognostic factor in anaplastic thyroid cancer[J]. Int J Endocrinol, 2014: 240513. |
| [7] | Akaishi J, Sugino K, Kitagawa W, et al. Prognostic factors and treatment outcomes of 100 cases of anaplastic thyroid carcinoma[J]. Thyroid, 2011, 21(11): 1183–1189. DOI:10.1089/thy.2010.0332 |
| [8] | Sugitani I, Miyauchi A, Sugino K, et al. Prognostic factors and treatment outcomes for anaplastic thyroid carcinoma: Atc research consortium of japan cohort study of 677 patients[J]. World J Surg, 2012, 36(6): 1247–1254. DOI:10.1007/s00268-012-1437-z |
| [9] | Yoshida A, Matuzu K. Analysis of long-term survivors in anaplastic thyroid carcinoma[J]. Nihon Geka Gakkai Zasshi, 2012, 113(4): 373–377. |
| [10] | Sugitani I, Hasegawa Y, Sugasawa M, et al. Super-radical surgery for anaplastic thyroid carcinoma: a large cohort study using the anaplastic thyroid carcinoma research consortium of japan database[J]. Head Neck, 2014, 36(3): 328–333. DOI:10.1002/hed.v36.3 |
| [11] |
张宗敏, 徐震纲, 唐平章, 等.
重新认识甲状腺未分化癌[J]. 中国医学科学院学报, 2006, 28(3): 322–324.
ZHANG Zongmin, XU Zhengang, TANG Pingzhang, et al. A retrospective analysis of anaplastic thyroid carcinoma[J]. Act Acad Med Sin, 2006, 28(3): 322–324. |
| [12] | Pierie JP, Muzikansky A, Gaz RD, et al. The effect of surgery and radiotherapy on outcome of anaplastic thyroid carcinoma[J]. Ann Surg Oncol, 2002, 9(1): 57–64. DOI:10.1245/aso.2002.9.1.57 |
| [13] | Sun C, Li Q, Hu Z, et al. Treatment and prognosis of anaplastic thyroid carcinoma: experience from a single institution in china[J]. PloS one, 2013, 8(11): 80011. DOI:10.1371/journal.pone.0080011 |
| [14] | Sherman EJ, Lim SH, Ho AL, et al. Concurrent doxorubicin and radiotherapy for anaplastic thyroid cancer: a critical re-evaluation including uniform pathologic review[J]. Radiother Oncol, 2011, 101(3): 425–430. DOI:10.1016/j.radonc.2011.09.004 |
| [15] |
房居高.
强化手术技能和规范诊疗是提高甲状腺癌疗效的根本[J]. 山东大学耳鼻喉眼学报, 2016, 30(2): 1–4.
FANG Jugao. Operation skill and standard diagnosis and treatment are the basics of improving the curative effect of thyroid carcinoma[J]. J Otolaryngol Ophthal Shandong Univ, 2016, 30(2): 1–4. DOI:10.6040/j.issn.1673-3770.1.2016.01 |
| [16] | Zhou M, Chen Y, Adachi M, et al. Single agent nanoparticle for radiotherapy and radio-photothermal therapy in anaplastic thyroid cancer[J]. Biomaterials, 2015, 57: 41–49. DOI:10.1016/j.biomaterials.2015.04.013 |
| [17] | Bhatia A, Rao A, Ang KK, et al. Anaplastic thyroid cancer: clinical outcomes with conformal radiotherapy[J]. Head Neck, 2010, 32(7): 829–836. |
| [18] | Lowe NM, Loughran S, Slevin NJ, et al. Anaplastic thyroid cancer: the addition of systemic chemotherapy to radiotherapy led to an observed improvement in survival-a single centre experience and review of the literature[J]. Sci World J, 2014: 674583. |
| [19] | Seto A, Sugitani I, Toda K, et al. Chemotherapy for anaplastic thyroid cancer using docetaxel and cisplatin: report of eight cases[J]. Surg Today, 2015, 45(2): 221–226. DOI:10.1007/s00595-013-0751-x |
| [20] | Savvides P, Nagaiah G, Lavertu P, et al. Phase ii trial of sorafenib in patients with advanced anaplastic carcinoma of the thyroid[J]. Thyroid, 2013, 23(5): 600–604. DOI:10.1089/thy.2012.0103 |
| [21] | Wein RO, Weber RS. Anaplastic thyroid carcinoma: Palliation or treatment?[J]. Curr Opin Otolaryngol Head Neck Surg, 2011, 19(2): 113–118. DOI:10.1097/MOO.0b013e328343af3d |
| [22] | Pennell NA, Daniels GH, Haddad RI, et al. A phase ii study of gefitinib in patients with advanced thyroid cancer[J]. Thyroid, 2008, 18(3): 317–323. DOI:10.1089/thy.2007.0120 |
 2017, Vol. 31
2017, Vol. 31

