2. 临沂市妇女儿童医院耳鼻咽喉头颈外科,山东 临沂 276000;
3. 青岛大学附属医院小儿外科,山东 青岛 266003
2. Women and Childrens Hospital of Linyi, Linyi 276000, Shandong, China;
3. Department of Pediatric Surgery, Affiliated Hospital of Qingdao University, Qingdao 266003, Shandong, China
儿童甲状腺癌是少见的恶性肿瘤,其中90%甚至更多的分化型甲状腺癌是乳头状癌,是儿童甲状腺恶性肿瘤中最常见的病理类型。儿童甲状腺癌易较早引起颈部淋巴结转移,具有浸润程度高、转移率高和死亡率低的特点,侵袭和转移是其最主要的特点。手术治疗、淋巴结清扫、术后131Ⅰ放射治疗以及内分泌治疗能够明显降低患者远期病死率。相关研究表明[1],乙酰肝素酶(heparanase, Hpa)和D2-40在成人甲状腺癌的表达与其侵袭性和转移性具有重要联系,但是Hpa和D2-40在儿童甲状腺癌中的表达国内外研究少见。我们检测了Hpa和D2-40在儿童甲状腺癌中的表达情况并分析其与儿童甲状腺癌的联系,以期为儿童甲状腺癌的诊疗和预后提供一定参考。
1 资料与方法 1.1 标本来源本项研究为回顾性研究。收集2002至2016年青岛大学附属医院病理科存档的甲状腺癌手术石蜡标本共90例,其中儿童甲状腺癌共计30例,男性8例,女性22例;成人甲状腺癌共计60例,其中男性17例,女性43例。儿童甲状腺癌中乳头状癌25例,滤泡状癌5例;有淋巴结转移25例,无淋巴结转移5例;平均年龄14.31岁(6~18岁)。成人甲状腺癌均为乳头状癌,无滤泡状癌;有淋巴结转移23例,无淋巴结转移37例;平均年龄54.82岁(45~60岁)。本研究通过医院伦理道德委员会的同意。
1.2 实验方法及试剂以上标本组织均4μm厚切片,4℃冰箱保存。石蜡组织切片中Hpa和D2-40蛋白表达水平采用免疫组化(streptavidin-perosidase,SP)法测定,PBS代替一抗作阴性对照。实验步骤参照免疫试剂盒说明书进行。兔抗人Hpa和D2-40多克隆抗体均购自北京博奥森生物技术有限公司,通用型SP免疫组化超敏试剂盒和DAB显色试剂盒均购自福州迈新公司。
1.3 结果判定由两位医师采用双盲法在光学显微镜下观察每张切片。每张切片连续观察5个高倍视野(×400)记100个细胞。对每例切片,均采用半定量分析法综合判定结果,从细胞浆染色强度和阳性细胞所占百分比进行评分,染色强度以多数细胞呈现的染色特性计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。染色强度与阳性细胞百分比的乘积:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
1.4 统计学处理应用SPSS 20.0软件。计数资料采用相对数指标描述分析,组间差异分析统计量采用χ2检验。检验水准α=0.05。
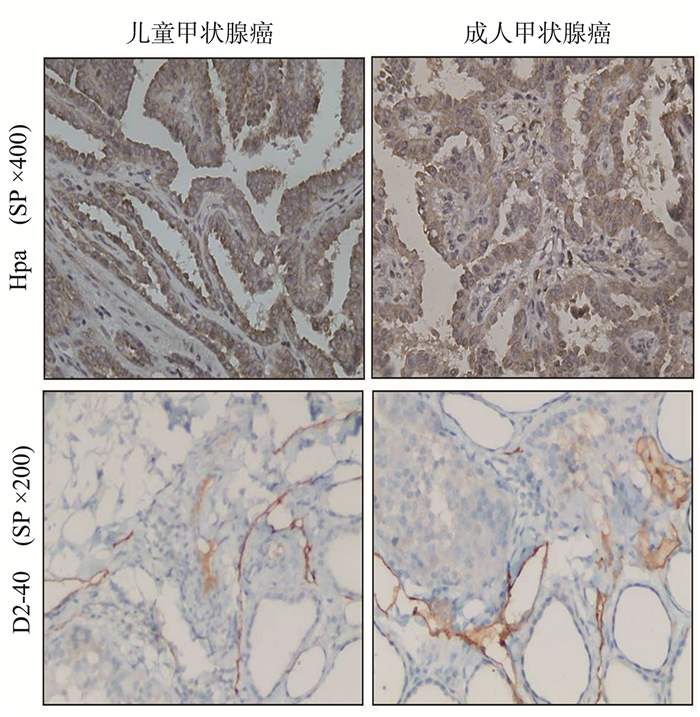
2 结果 2.1 Hpa和D2-40在儿童甲状腺癌及成人甲状腺癌中的表达情况光学显微镜下,Hpa阳性表达于甲状腺腺细胞的胞膜和/或胞质,D2-40的阳性表达于甲状腺淋巴管内皮细胞的胞膜和/或胞质,染色呈棕黄色或黄褐色(图 1)。Hpa和D2-40在儿童及成人甲状腺癌组织中均呈高阳性表达,两者差异无统计学意义(P=0.069,P=0.343)(表 1)。这提示Hpa和D2-40两种蛋白在甲状腺癌组织中的表达与年龄无关。
|
图 1 儿童甲状腺癌和成人甲状腺癌组织中Hpa(SP,×400)和D2-40(SP,×200)的表达 Figure 1 The expression of Hpa (SP, ×400) and D2-40 (SP, ×200) in cancer specimens of children and adolescents with thyroid cancer and in adult thyroid cancer |
| 表 1 Hpa和D2-40在儿童甲状腺癌和成人甲状腺癌中的表达[n(%)] Table 1 Expressions of Hpa and D2-40 in pediatric thyroid carcinoma and adult thyroid carcinoma[n(%)] |
见表 2~3。在儿童甲状腺癌组织中,Hpa和D2-40在淋巴结转移组中呈高表达,两者差异具有统计学意义;其中乳头状癌和滤泡状癌Hpa的表达差异具有统计学意义。在成人甲状腺癌组织中,Hpa的表达亦是在淋巴结转移组高,差异具有统计学意义(P=0.006)。Hpa与D2-40的表达无论是儿童组还是成人组,不同性别及是否侵犯包膜组间差异均无统计学意义。
| 表 2 Hpa和D2-40在儿童甲状腺癌生物学特征中的表达[n(%)] Table 2 Expression of the biological characteristics of Hpa and D2-40 in pediatric thyroid carcinoma[n(%)] |
| 表 3 Hpa和D2-40在成人甲状腺癌生物学特征中的表达[n(%)] Table 3 Expression of the biological characteristics of Hpa and D2-40 in adult thyroid carcinoma[n(%)] |
甲状腺癌是内分泌系统最常见的恶性肿瘤,且发病率呈逐年上升趋势,尤其是儿童患病率逐年升高,这得到国内外学者们高度的关注。儿童甲状腺癌常以颈部无痛性肿块为首发症状,其临床症状有时与甲状腺良性肿块甚为相似,因此临床上误诊率较高[2],容易被误诊为非特异性淋巴结炎或颈淋巴结结核。另外,儿童甲状腺癌淋巴结转移率较高,有时转移淋巴结甚至早于原发病灶被发现。
美国癌症联合委员会(AJCC) TNM分期标准对分化型甲状腺癌的分期中指出:患者年龄 < 45岁时,无论肿瘤大小、局部侵犯程度及淋巴结转移与否,不伴有远处转移者均为Ⅰ期,出现远处转移者即为Ⅱ期[3],故儿童患者不伴远处转移均应为Ⅰ期,伴远处转移为Ⅱ期。但事实上,患有甲状腺乳头状癌的儿童一旦发现颈部淋巴结转移,其肺转移发生率、复发率分别增加20%和53%,因此TNM分期难以预测儿童甲状腺癌复发风险,更难以指导治疗[4]。因此美国甲状腺学会(ATA)在2015年初颁布了专门针对儿童甲状腺结节与分化型甲状腺癌的管理指南[5],在此基础上根据TNM分期制定了儿童甲状腺乳头状癌的风险等级评估,评估的主要依据是有无淋巴结转移及转移范围。然而,目前还没有可靠的生物学指标可用于评估儿童甲状腺癌的发生和淋巴结转移。
Hpa和D2-40两种蛋白在儿童甲状腺癌中的表达,国内外研究较少。Hpa和D2-40是两种不同的酶类,Hpa能激活淋巴管内皮细胞生长通路,进而促发淋巴管的生成;而D2-40在实验研究中常用于标记淋巴管内皮,以区别血管内皮,被认定是最具有特异性的淋巴管标记物[6]。因此我们推断两种生物蛋白标记物同样可能与儿童甲状腺癌淋巴转移相关,并做出了相关研究。
Hpa也称为类肝素酶,是一种葡萄糖醛酸内切酶,在甲状腺腺细胞的胞膜和胞质中广泛存在,能够特异性识别并剪切硫酸乙酰肝素(HS)侧链,通过调节HS生成和降解的平衡,以维持细胞和组织的增生、分化、黏附和迁移活动[7-8]。Hpa是近年发现的重要功能酶,在转移的恶性肿瘤中普遍存在,它在肿瘤的生长分化、转移和侵袭过程中起重要作用:一方面Hpa的过度表达使HS侧链水解,从而破坏了细胞外基质和基底膜的稳定性,导致肿瘤细胞通过基底膜进入基质和血管壁进一步生长转移;另一方面,肿瘤的生长转移使HS在体内的平衡进一步被打破,导致形成了恶性循环[9]。另外,Hpa还可以促进肿瘤细胞释放血管内皮细胞生长因子(vascular endothelial growth factor,VEGF),而VEGF-C是最先发现的淋巴管生成因子,它主要通过激活酪氨酸激酶受体信号转导途径,和/或激活Ras/MAPA(丝裂原蛋白激酶)信号转导通路,使淋巴管内皮细胞生长通路激活,进而促发生成淋巴管[10]。最新研究表明,Hpa蛋白在头颈部肿瘤中,尤其在淋巴结转移的肿瘤中高表达,并与淋巴结转移呈明显正相关[11]。同样,我们的研究结果也证实了Hpa蛋白在甲状腺癌细胞组织中,尤其是在儿童甲状腺癌中呈强阳性表达并与淋巴转移密切相关。
D2-40是一种新型淋巴管内皮细胞标记物,分子量为40KD,属于单克隆IgG抗体,具有高度的敏感性和特异性,主要定位于淋巴管内皮细胞的胞浆和胞膜上[12-13]。D2-40可识别M2A(肿瘤胚胎性抗原),M2A为一种相对分子质量为40000的唾液酸糖蛋白,只在淋巴管内皮中特异性地表达,在血管内皮中无表达,所以在实验中用于标记微淋巴管[14]。D2-40在淋巴管瘤中阳性表达,在良性血管肿瘤中为阴性,因此被用于判断肿瘤组织微淋巴管形成、癌细胞是否发生转移和浸润[13]。我们研究的结果发现,D2-40在儿童甲状腺癌与成人甲状腺癌中均呈阳性表达并与淋巴结的转移密切相关,这提示D2-40参与了甲状腺癌,尤其是儿童甲状腺癌淋巴结转移的过程。
近年来随着肿瘤分子水平和蛋白水平的研究进展加深,学者们越来越关注与甲状腺癌发生发展、转归和预后有关的肿瘤标志物,特异性高、敏感性强及可信性高是理想的肿瘤标志物的特点[15]。综合本研究结果,儿童甲状腺癌患者中Hpa和D2-40均呈现高表达,且与淋巴转移高度相关,提示Hpa和D2-40检测在儿童甲状腺癌淋巴转移方面有一定的临床价值,可为儿童甲状腺癌的治疗和术后管理提供重要参考。
| [1] | 田亮, 桑伟, 商晓青, 等. 类肝素酶、VEGF-C、D2-40在甲状腺癌中的表达及临床意义[J]. 中国癌症杂志, 2010, 20(2): 116–120. |
| [2] | 杨传盛, 张诠, 郭朱明, 等. 儿童甲状腺癌22例临床分析[J]. 癌症, 2008, 27(3): 311–314. |
| [3] | American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM Hauqen BR, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2009, 19(11): 1167–1214. DOI:10.1089/thy.2009.0110 |
| [4] | 胡欣, 李春睿, 徐书杭, 等. 2015年美国甲状腺学会儿童甲状腺结节与分化型甲状腺癌管理指南的介绍[J]. 中华内分泌代谢杂志, 2016, 32(4): 265–268. |
| [5] | Francis GL, Waguespack SG, Bauer AJ, et al. Management guideline for children with thyroid nodules and differentiated thyroid cance[J]. Thyroid, 2015, 25(7): 716–759. DOI:10.1089/thy.2014.0460 |
| [6] | Kaiserling E. Immunohistochemical identification of lymph vessels with D2-40 in papillary thyroid carcinomas[J]. Pathology, 2004, 25(5): 362–374. |
| [7] | Higashi N, Waki M, Sue M, et al. Heparanase-mediated cleavage of macromolecular heparin accelerates release of granular components of mast cells from extracellular matrices[J]. Biochem J, 2014(2): 291–299. |
| [8] | 杨传家, 宫建, 吴锋, 等. 乙酰肝素酶与甲状腺乳头状癌淋巴结转移的相关性研究[J]. 广西科学, 2015, 22(1): 44–47. |
| [9] | 杨传家, 宫建, 刘臻, 等. 乙酰肝素酶及基质金属蛋白酶-9在甲状腺乳头状癌淋巴结转移中的作用[J]. 广东医学, 2014(20): 3173–3175. |
| [10] | Yu XM, Lo CY, Chan WF, et al. Increased expression of vascular endothelial growth factor C in papillary thyroid carcinoma correlates with cervical lymph node metastases[J]. Clin Cancer Res, 2005, 11(22): 8063–8069. DOI:10.1158/1078-0432.CCR-05-0646 |
| [11] | Cohen-Kaplan V, Naroditsky I, Zetser A, et al. Heparanase induces VEGF C and facilitates tumor lymphangiogenesis[J]. Int Cancer, 2008, 123: 2566–2573. DOI:10.1002/ijc.v123:11 |
| [12] | 李英, 张冬娅. D2-40在结直肠腺癌中的表达及临床意义[J]. 山西医科大学学报, 2009, 40(8): 696–699. |
| [13] | 杨传家, 宫建, 李景姝, 等. D2-40在甲状腺乳头状癌淋巴结转移中的作用[J]. 中国医学工程, 2013, 21(4): 1–2. |
| [14] | Kahn HJ, Bailey D, Marks A. Monoclonal antibody D2-40, a new marker of lymphatic endothelium reacts with Kaposis sarcoma and a subset of angiosarcomas[J]. Mod Pathol, 2002, 15(4): 434–440. DOI:10.1038/modpathol.3880543 |
| [15] | 邱杰, 孙彦. 肿瘤标志物检测在甲状腺癌临床诊治中的意义[J]. 山东大学耳鼻喉眼学报, 2016, 30(2): 28–31. DOI:10.6040/j.issn.1673-3770.1.2016.08 |
 2017, Vol. 31
2017, Vol. 31

