2. 湖北省孝感市 第一人民医院五官科, 湖北 孝感 432100
2. Department of ophthalmology and otorhinolaryngology, The First People's Hospital of Xiaogan, Xiaogan 432100, Hubei, China
喉癌是常见的恶性肿瘤,占头颈部恶性肿瘤的26%~30%,喉癌病理组织学以鳞状细胞癌常见,约占85%~95%[1]。吸烟和饮酒是喉癌的主要致病因素,其他的致病因素包括饮食、环境、职业暴露、人乳突状瘤病毒(human papillomavirus,HPV)感染等[2-3]。胃食管反流病(gastroesophageal reflux disease,GERD)是指胃、十二指肠内容物反流至食管引起烧心等症状,可引起反流性食管炎,以及咽喉、气道等食管以外的组织损害。其中胃内容物反流的方式包括胃食管反流(gastroesophageal reflux,GER)和咽喉反流(laryngopharyngeal reflux,LPR)两种。在这些患有GERD的人群当中,喉镜检查经常能发现喉水肿、肉芽肿、乳突状瘤、接触性溃疡、息肉等病变。尽管越来越多的证据表明GERD与喉的慢性炎症有一定的联系,但关于GERD与喉癌之间关系的研究却充满争议。部分研究认为GER或LPR是导致喉癌发生的危险因素[4-10],而另外一些研究却得出了相反的结论[11-13]。2015年3月至2015年6月我们针对国内外发表的关于喉癌和胃食管反流病的文献行Meta分析,探讨GERD对喉癌发生的影响。
1 资料与方法 1.1 纳入与排除标准 1.1.1 纳入标准① 评价GER和/或LPR与喉癌之间关系的病例对照研究;② 病例组与对照组的来源明确及喉癌的诊断明确;③ 病例组和对照组中的数据充分。
1.1.2 排除标准① 下咽癌或喉咽癌作为研究组的文献;② 以良性肿瘤作为对照组的研究;③ 重复报告或资料雷同、质量较差等无法利用的文献;④ 综述、摘要或非病例对照研究。
1.2 资料检索计算机检索Pubmed、Web of Knowledge、Embase、CBM和CNKI数据库,文献检索起至时间从建库到2015年5月止,收集公开发表的所有关于GER和/或LPR与喉癌之间关系的病例对照研究。遵从PRISMA原则(Preferred Reporting Items for Systematic reviews and Meta-Analyses),以主题词和自由词联合进行检索。英文检索词包括“larynx carcinoma,laryngeal cancer,reflux,gastroesophageal reflux,laryngopharyngeal reflux”等。中文检索词包括“喉癌,喉鳞状细胞癌,反流,胃食管反流,咽喉反流”等。
1.3 文献筛选及资料提取由两位研究者独立进行文献质量评价并按设计好的表格提取资料,如遇分歧,通过讨论或根据第三位研究人员的意见解决。从纳入文献中提取信息包括:第一作者、发表年代、国家、病例组和对照组的例数、GER和LPR的诊断方法以及与吸烟和饮酒之间的联系。
1.4 质量评价采用非随机研究偏倚风险评估方法(NOS)[14]对纳入研究的方法学的质量进行评估。NOS包括研究对象选择(4个条目,4分)、组间可比性(1个条目,2分)和研究对象的暴露(3个条目,3分),总共9分。如遇分歧则讨论解决,必要时根据第三方的意见进行商议,最后达成一致性意见。
1.5 统计学处理采用RevMan 5.3和Stata 13.1软件进行统计学分析。首先利用加布雷斯图示法[15]对纳入的研究进行初步的异质性判断,而后通过作森林图计算优势比(OR)及其95%CI作为效应量表示结果,再采用χ2检验对纳入研究进行异质性检验,检验水准为α=0.1,即P≤0.1时,各研究结果间存在异质性。采用I2对异质性进行定量分析,I2≥50%存在异质性。如各研究结果间存在异质性,则进行亚组分析来探讨异质性的来源,并采用随机效应模型进行Meta分析,最后进行敏感性分析来判断结果的稳定性。利用harbord法[16]对文献发表的偏倚进行检测。
2 结 果 2.1 文献筛选流程初检共获得320篇文献,通过阅读文题和摘要排除302篇文献。仔细阅读全文排除5篇文献,其中3篇文献没有设置对照组,1篇没有明确描述反流的情况,1篇报告的数据重复,最终共纳入13个病例对照研究[4-13, 17-19],见图 1。
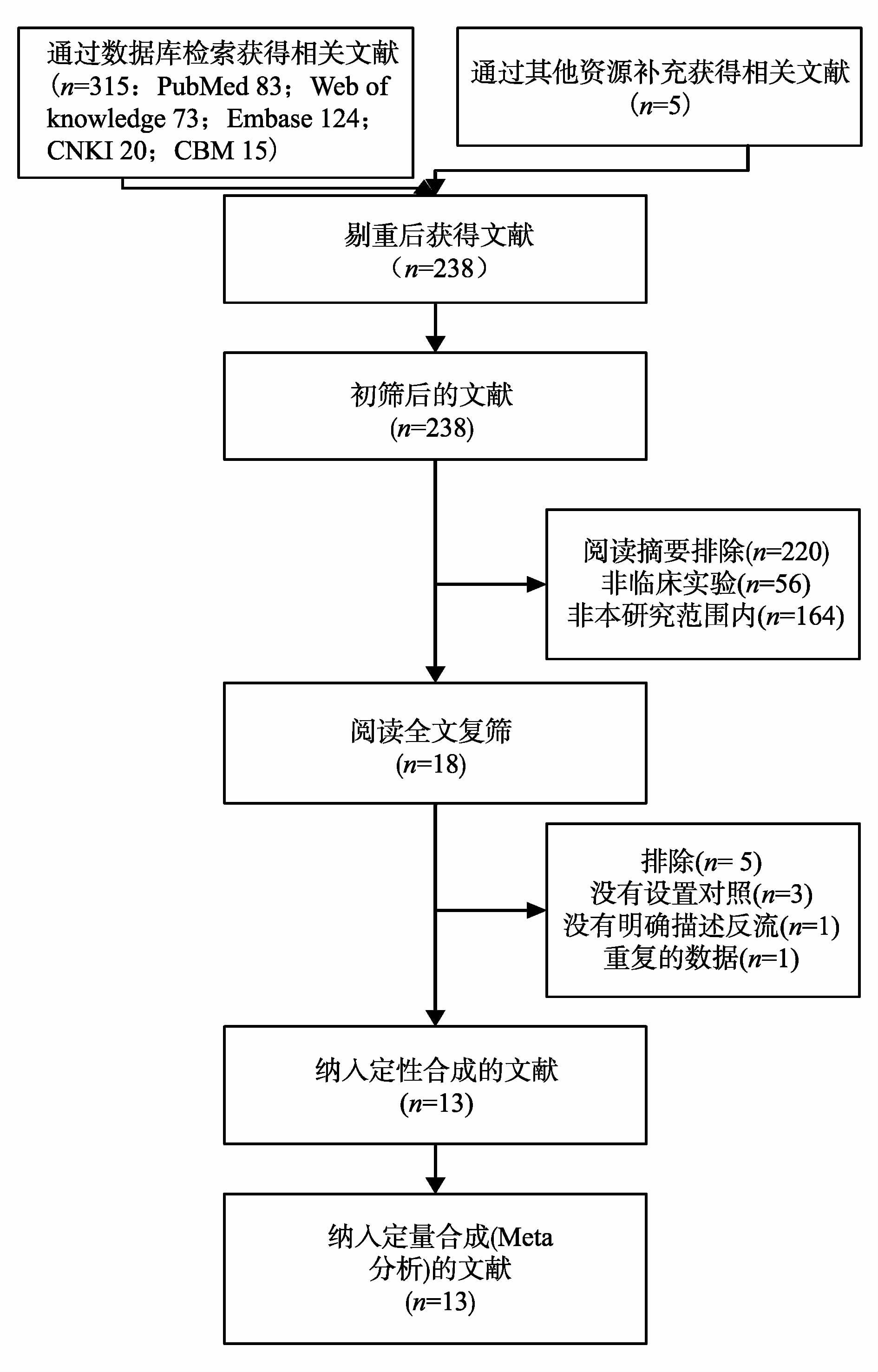
|
图 1 文献筛选流程及结果 Figure 1 Process and result of literature screening |
纳入研究的基本特征和质量评价结果分别见表 1和表 2。纳入的13篇文献中5篇[6, 8, 10-11, 13]来自美国,5篇[4-5, 9, 12, 17]来自欧洲,3篇[7, 18-19]来自亚洲;8篇文献[4-8, 10]报道的胃食管反流病的类型是GER,2篇[9, 19]报道的是LPR,3篇[12, 17-18]既报道了GER,也报道了LPR;6篇文献[10-12, 17-19]采取的GERD的诊断方法是pH监测,3篇[6, 8, 13]采取的方法是ICD-9编码,3篇[4-5, 7]采取的是EGD法,2篇文献[8-9]采用了症状诊断法;6篇文献[6-8, 13, 18-19]既提到了吸烟史,又提及了饮酒的情况。13篇文献中只有1篇[4]纳入的研究对象是既没有吸烟也没有饮酒史。
| 表 1 纳入研究的基本特征 Table 1 The basic characteristics of included studies |
| 表 2 纳入研究的方法学质量评价 Table 2 Quality evaluation of methodologyof included studies |
从表 1和图 2可以看出各研究间有明显的异质性特征,表 1示各研究间的GERD的类型、GERD的诊断方法以及相关的危险因素各不相同,提示一部分异质性的存在;图 2有7项研究在95%CI之外,也提示各研究间存在异质性。
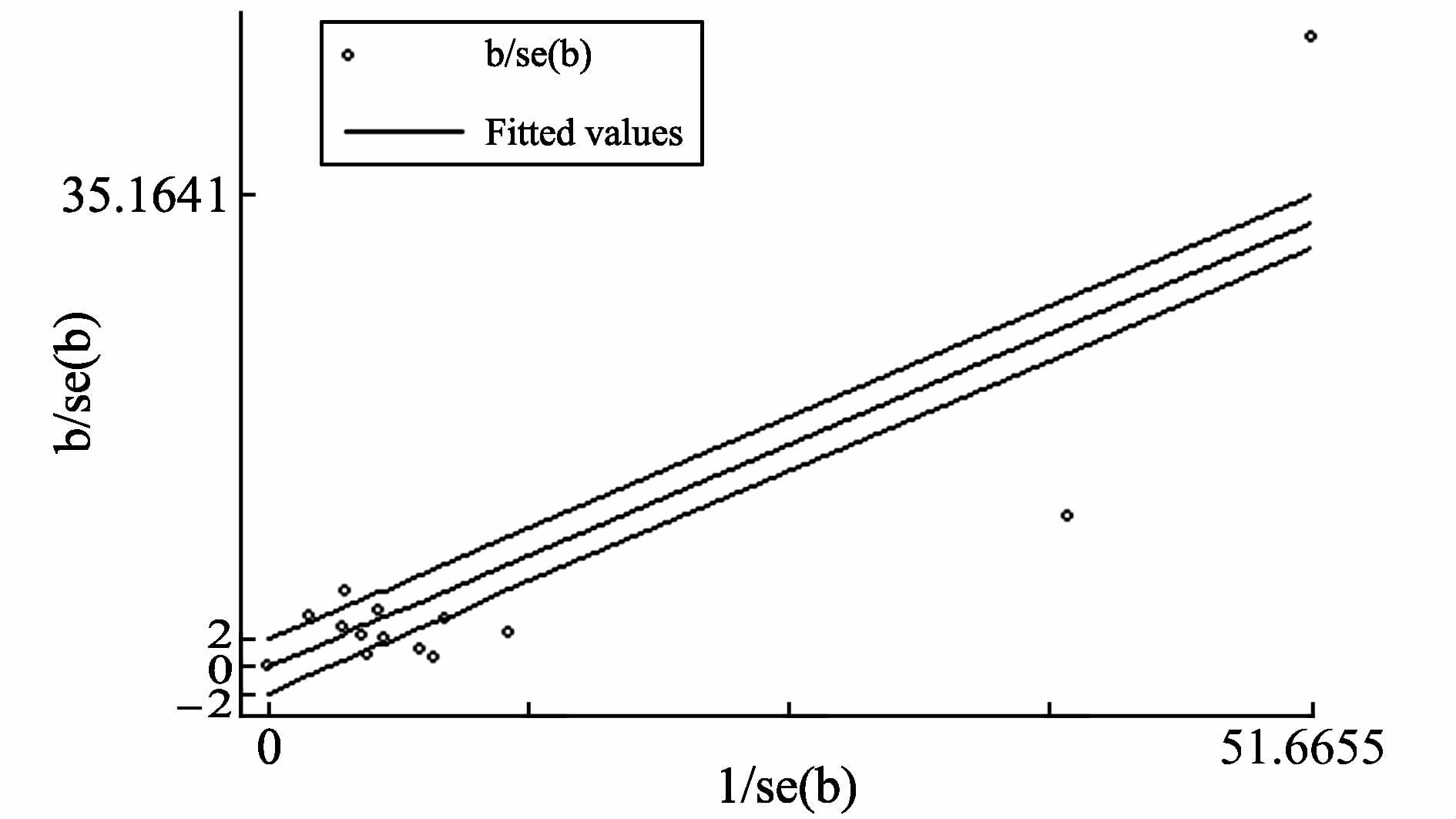
|
图 2 加布雷斯图示异质性检验 Figure 2 Galbraith plot test for heterogeneity |
Meta分析中GER亚组各研究间存在异质性(P<0.00001,I2=97%),随机效应模型的Meta分析结果显示,两组间GER的阳性率差异有统计学意义[OR=2.40,95%CI(1.67,3.46),P<0.00001];LPR亚组各研究间也存在异质性(P=0.08,I2=52%),随机效应模型的Meta分析结果显示,两组间LPR的阳性率差异有统计学意义[OR=3.97,95%CI(1.86,8.47),P=0.0004];总的效应量存在异质性(P<0.00001,I2=96%),两组间GERD的阳性率差异有统计学意义[OR=2.68,95%CI(1.94,3.70),P<0.00001]。各亚组间无异质性(P=0.24,I2=26.6%)(图 3)。
Meta分析中,基于pH监测诊断的亚组中各研究间存在异质性(P=0.03,I2=59%),随机效应模型的Meta分析结果显示,两组间GERD的阳性率差异有统计学意义[OR=2.36,95%CI(1.44,3.84),P=0.0006];基于ICD-9编码诊断的亚组中各研究间存在异质性(P<0.00001,I2=99%),随机效应模型的 Meta 分析结果显示,两组间GERD的阳性率差异无统计学意义[OR=1.46,95%CI(0.79,2.69),P=0.23];基于EGD法诊断的亚组中各研究间无异质性(P=0.82,I2=0%),随机效应模型的Meta分析结果显示,两组间GERD的阳性率差异有统计学意义[OR=5.54,95%CI(3.51,8.76),P<0.00001];基于症状诊断的亚组中各研究间无异质性(P=0.67,I2=0%),随机效应模型的Meta分析结果显示,两组间GERD的阳性率差异有统计学意义[OR=2.33,95%CI(1.15,4.76),P=0.02]。各亚组间存在异质性(P=0.004,I2=77.9%)(图 4)。

|
图 3 GER、LPR与喉癌关系的Meta分析 Figure 3 meta-analysis of relationship between GER,LPR with laryngocarcinoma |
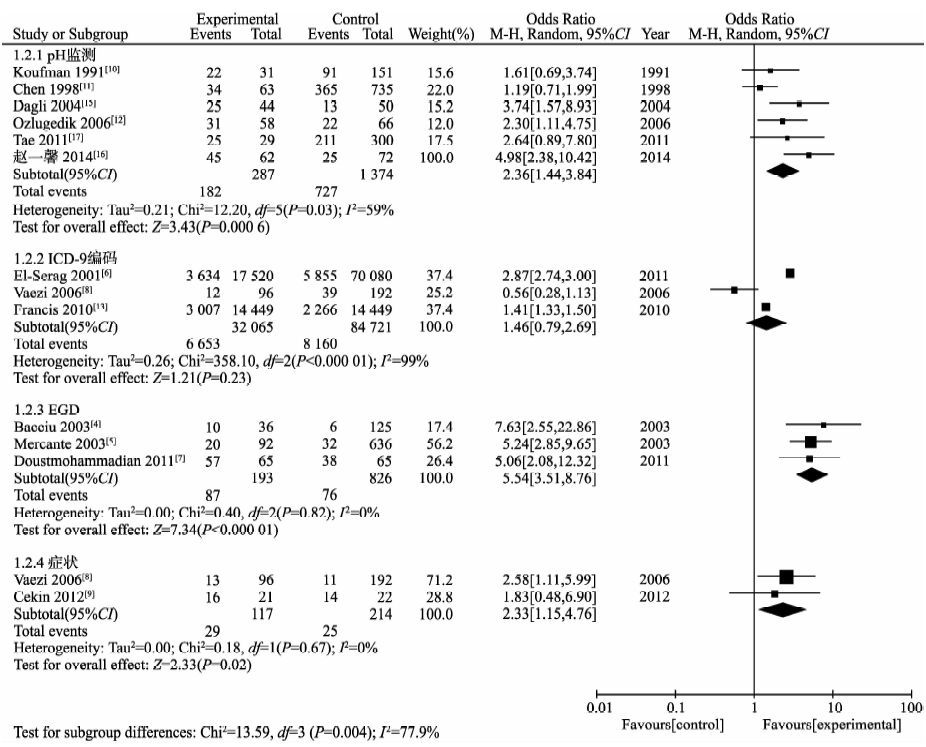
|
图 4 基于不同诊断方法的GERD与喉癌关系的Meta分析 Figure 4 meta-analysis of relationship between GERDbased on the different diagnosis methodswith laryngocarcinoma |
使用依次逐项剔除纳入的单个研究的方法进行敏感性分析。图 5结果显示逐个剔除单个研究后合并的效应量在可信区间之内,表明本Meta分析结果稳定。图 6示纳入的研究沿回归线呈大致的对称分布,定量计算的P值为0.890,表明本Meta分析纳入的研究没有明显发表偏倚。

|
图 5 敏感性分析 Figure 5 Sensitivity analysis |
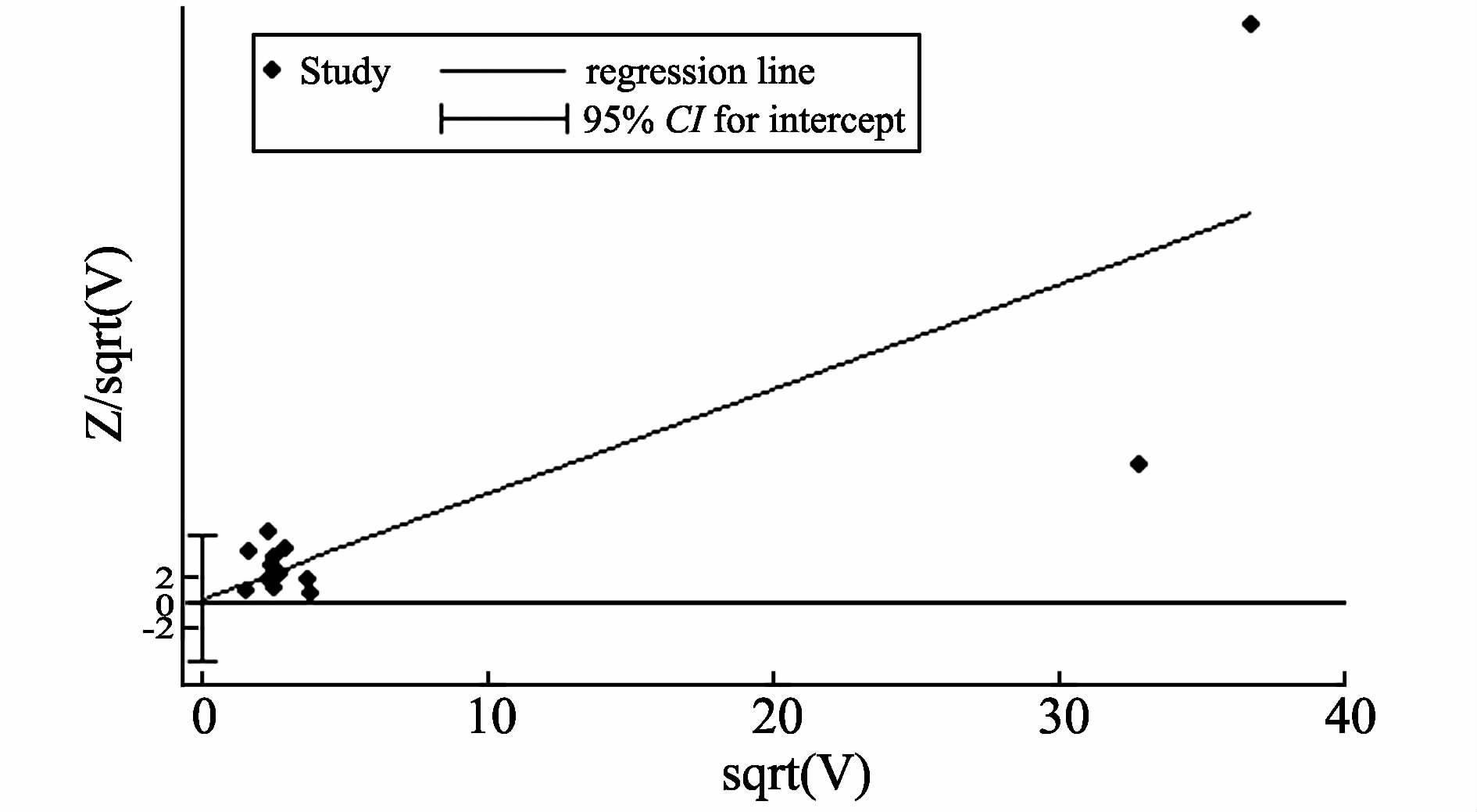
|
图 6 harbord法检测发表偏倚 Figure 6 Publication bias tested by the Harbord-Egger bias indicator |
多数研究证实GERD是食管癌的一个主要致病因素。早在1960年,Gabriel等[20]就提出胃酸反流经食管到达咽喉部可能引发该部位的肿瘤的假说,其在一项研究中报道了10例喉部良性病变患者因胃酸反流发展为鳞状细胞癌,并推测胃酸反流损伤咽喉部黏膜的机制可能是长期慢性炎症刺激产生氧自由基、活性氧等活性物质,经增殖细胞内信号转导通路的活化,最终导致细胞内原癌基因的激活而引发肿瘤病变[21]。本Meta分析结果显示,喉癌组中GERD的阳性率是对照组的2.68倍[95%CI(1.94,3.70)],提示GERD可能是喉癌的一种致病因素。
从表 1和图 2可以看出本Meta分析中各研究间存在明显的异质性,因此就GERD的类型作亚组分析,结果显示:喉癌组中GER阳性表达率比对照组高,差异有统计学意义[OR=2.40,95%CI(1.67,3.46),P<0.00001];喉癌组中LPR阳性表达率也高于对照组,差异具有统计学意义[OR=3.97,95%CI(1.86,8.47),P=0.0004],说明GERD的类型不影响此次Meta分析的结果。同样就GERD的诊断方法也做了亚组分析,结果显示:基于pH监测诊断的亚组中,喉癌组的GERD阳性表达率比对照组高,差异有统计学意义[OR=2.36,95%CI(1.44,3.84),P=0.0006];而基于ICD-9编码诊断的亚组中,两组间GERD的阳性率差异无统计学意义[OR=1.46,95%CI(0.79,2.69),P=0.23];基于EGD法诊断的亚组中,喉癌组的GERD阳性表达率比对照组高,差异有统计学意义[OR=5.54,95%CI(3.51,8.76),P<0.00001];基于症状诊断的亚组中两组间GERD的阳性率差异有统计学意义[OR=2.33,95%CI(1.15,4.76),P=0.02]。基于EGD和症状诊断的两亚组内无异质性,因此GERD的不同诊断方法可以解释一部分本Meta分析产生的异质性原因。另外基于ICD-9编码诊断的亚组中,两组间GERD的阳性率差异无统计学意义,而该亚组所纳入的3个研究中有2个[6, 13]的样本量明显大于其他的研究,因此,应谨慎地看待此次Meta分析产生的结果。
GERD在喉癌的进展中的作用目前尚缺乏统一的结论。除吸烟和饮酒外,GERD是否喉癌发病的独立危险因素值得进一步研究。本研究只有1篇[4]纳入的研究对象既没有吸烟也没有饮酒史,而且GERD人群中吸烟、饮酒率较对照组高,考虑受到这些混杂因素的影响,因此评价GERD是喉癌的一种独立的危险因素相对困难。此外,有研究报道吸烟和饮酒可以诱导和加重GERD[22-23],但本Meta分析中的只有4篇文献[6, 8, 13, 19]为了排除吸烟和饮酒这两种因素的影响采用了多变量回归分析,结果显示2篇[6, 8]支持GERD是喉癌的一种独立的危险因素,另外2篇[13, 19]则不支持,而其他文献未提及这两种因素的影响,因此不能排除对Meta分析结果的可靠性的影响。另外,本Meta分析中只有2篇文献[13, 18]提及了不同部位喉癌中GERD阳性率的差异,其中赵一馨等[18]报道声门上型喉癌与声门型喉癌间的GERD阳性率没有统计学差异,而Francis等[13]报道的结果与之相反。因此今后的研究应进一步探讨GERD及其他危险因素对不同部位喉癌的影响。
本Meta分析也存在一定的局限性:① 各研究间存在明显的异质性,除了上述讨论的来源外,还可能存在样本量的大小、研究对象的选择、肿瘤的类型等差异;② 纳入文献均为正式发表的文献,而缺乏灰色文献,可能会漏掉阴性结果的研究而导致发表偏倚;③ 对照组的纳入对象来自不同的群体,可能存在选择性偏倚。因此本Meta分析的结果还需更多设计严谨、细致的高质量病例对照研究来进一步证实。
| [1] |
Pirzadeh A, Doustmohammadian N, Khoshbaten M, et al. Is there any association between Helicobacter Pylori infection and laryngeal carcinoma?[J].
Asian Pac J Cancer Prev,2011, 12 (4) : 897-900.
( 0) 0)
|
| [2] |
Sturgis E M, Pytynia K B. After the smoke clears: environmental and occupational risks for carcinoma of the upper aerodigestivetract[J].
Cancer J,2005, 11 (2) : 96-103.
( 0) 0)
|
| [3] |
Pavia M, Pileggi C, Nobile C G, et al. Association between fruit and vegetable consumption and oral cancer: a meta-analysis of observational studies[J].
Am J Clin Nutr,2006, 83 (5) : 1126-1134.
( 0) 0)
|
| [4] |
Bacciu A, Mercante G, Ingegnoli A, et al. Effects of gastroesophageal reflux disease in laryngeal carcinoma[J].
Clin Otolaryngol Allied Sci,2004, 29 (5) : 545-548.
( 0) 0)
|
| [5] |
Mercante G, Bacciu A, Ferri T, et al. Gastroesophageal reflux as a possible co-promoting factor in the development of the squamous-cell carcinoma of the oral cavity, of the larynx and of the pharynx[J].
Acta Otorhinolaryngol Belg,2003, 57 (2) : 113-117.
( 0) 0)
|
| [6] |
El-Serag H B, Hepworth E J, Lee P, et al. Gastroesophageal reflux disease is a risk factor for laryngeal and pharyngeal cancer[J].
Am J Gastroenterol,2001, 96 (7) : 2013-2018.
( 0) 0)
|
| [7] |
Doustmohammadian N, Naderpour M, Khoshbaten M, et al. Is there any association between esophagogastric endoscopic findings and laryngeal cancer?[J].
Am J Otolaryngol,2011, 32 (6) : 490-493.
( 0) 0)
|
| [8] |
Vaezi M F, Qadeer M A, Lopez R, et al. Laryngeal cancer and gastroesophageal reflux disease: a case-control study[J].
Am J Med,2006, 119 (9) : 768-776.
( 0) 0)
|
| [9] |
Cekin E, Ozyurt M, Erkul E, et al. The association between Helicobacter pylori and laryngopharyngeal reflux in laryngeal pathologies[J].
Ear Nose Throat J,2012, 91 (3) : E6-E9.
( 0) 0)
|
| [10] |
Koufman J A. The otolaryngologic manifestations of gastroesophageal reflux disease (GERD): a clinical investigation of 225 patients using ambulatory 24-hour pH monitoring and an experimental investigation of the role of acid and pepsin in the development of laryngeal injury[J].
Laryngoscope,1991, 101 (4 Pt 2 Suppl53) : 1-78.
( 0) 0)
|
| [11] |
Chen M Y, Ott D J, Casolo B J, et al. Correlation of laryngeal and pharyngeal carcinomas and 24-hour pH monitoring of the esophagus and pharynx[J].
Otolaryngol Head Neck Surg,1998, 119 (5) : 460-462.
( 0) 0)
|
| [12] |
Ozlugedik S, Yorulmaz I, Gokcan K. Is laryngopharyngeal reflux an important risk factor in the development of laryngeal carcinoma?[J].
Eur Arch Otorhinolaryngol,2006, 263 (4) : 339-343.
( 0) 0)
|
| [13] |
Francis D O, Maynard C, Weymuller E A, et al. Reevaluation of gastroesophageal reflux disease as a risk factor for laryngeal cancer[J].
Laryngoscope,2011, 121 (1) : 102-105.
( 0) 0)
|
| [14] |
Wells G A, Shea B, O'Connell D, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomized studies in meta-analyses[J].
Available: www.ohri.ca/programs/clinical_epidemiology/oxford.asp,2012 .
( 0) 0)
|
| [15] |
张天嵩, 钟文昭, 张素, 等. Stata在Meta分析时异质性评价中的应用[J].
循证医学,2008, 8 (4) : 231-234.
ZHANG Tiansong, ZHONG Wenzhao, ZHANG Su, et al. Stata in assessing heterogeneity in meta-analysis[J]. J Evi-based Med,2008, 8 (4) : 231-234. (  0) 0)
|
| [16] |
Harbord R M, Egger M, Sterne J A. A modified test for small-study effects in meta-analyses of controlled trials with binary endpoints[J].
Stat Med,2006, 25 (20) : 3443-3457.
( 0) 0)
|
| [17] |
Dagli S, Dagli U, Kurtaran H, et al. Laryngopharyngeal reflux in laryngeal cancer[J].
Turk J Gastroenterol,2004, 15 (2) : 77-81.
( 0) 0)
|
| [18] |
赵一馨, 张立红, 张春芳, 等. 喉癌患者并发咽喉反流的初步观察[J].
中华耳鼻咽喉头颈外科杂志,2014, 49 (5) : 356-361.
ZHAO Yixin, ZHANG Lihong, ZHANG Chunfang, et al. Research on the association of the laryngeal carcinoma and laryngopharyngeal reflux[J]. Chin J Otorhinolarynol Head Neck Surg,2014, 49 (5) : 356-361. (  0) 0)
|
| [19] |
Tae K, Jin B J, Ji Y B, et al. The role of laryngopharyngeal reflux as a risk factor in laryngeal cancer: a preliminary report[J].
Clin Exp Otorhinolaryngol,2011, 4 (2) : 101-104.
( 0) 0)
|
| [20] |
Gabriel C E, Jones D G. The importance of chronic laryngitis[J].
J Laryngol Otol,1960, 74 : 349-357.
( 0) 0)
|
| [21] |
Krahulec I, Urbanova O, Simko S. Importance of laryngostroboscopic examination for diagnosis and therapy of chronic hypertrophic laryngitis[J].
Cesk Otolaryngol,1976, 25 (3) : 170-173.
( 0) 0)
|
| [22] |
Wynder E L, Stellman S D. Comparative epidemiology of tobacco-related cancers[J].
Cancer Res,1977, 37 (12) : 4608-4622.
( 0) 0)
|
| [23] |
Zeka A, Gore R, Kriebel D. Effects of alcohol and tobacco on aerodigestive cancer risks: a meta-regression analysis[J].
Cancer Causes Control,2003, 14 (9) : 897-906.
( 0) 0)
|
 2016, Vol. 30
2016, Vol. 30

