2. 山东大学,健康体检中心,山东 济南 250012
2. Depadment of Physical Examination Center, Qilu Hospital of Shandong University, Jinan 250012, Shandong, China
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome, OSAHS)是一种严重危害人类健康的慢性睡眠呼吸障碍性疾病,其最主要的病理生理机制为慢性间歇性缺氧(chronic intermittent hypoxia, CIH)。临床观察OSAHS患者多合并肥胖,基础研究表明间歇性缺氧可抑制小鼠富含甘油三酯的脂蛋白的降解,从而导致体内脂肪的堆积[1],可推测OSAHS患者可能存在血脂代谢异常,国内外对OSAHS患者的不同血脂代谢指标进行过大量研究,但结果不尽相同。已知脂代谢异常是动脉粥样硬化的病变基础,但OSAHS的严重程度与颈动脉粥样斑块的形成是否相关尚不明确。本研究旨在通过比较不同程度的OSAHS患者颈动脉斑块的发生率,探讨OSAHS与动脉粥样硬化的关系,同时通过对比OSAHS患者与健康人群血脂代谢的具体差异,为OSAHS患者脂质代谢机制的研究提供临床依据,为OSAHS诊疗及相关并发症的预防提供理论基础。
1 资料与方法 1.1 一般资料OSAHS组选取2015年11月至2016年7月在山东大学齐鲁医院耳鼻咽喉科、卫生部耳鼻喉科科学重点实验室经多导睡眠监测确诊为OSAHS的男性患者99例,22~59(42.40±7.75)岁,所有患者按AHI分为轻中度OSAHS组(5次/h≤AHI<30次/h)、重度OSAHS组(30次/h≤AHI<55次/h)和极重度OSAHS组(AHI≥55次/h)。对照组随机选取同时段在山东大学齐鲁医院查体中心查体,通过睡眠相关调查问卷及ESS量表排除睡眠呼吸障碍及其他睡眠相关性疾病的男性48例,23~54(39.92±8.81)岁。
1.2 诊断依据[2]及排除标准通常有白天嗜睡、睡眠时严重打鼾和反复的呼吸暂停现象,查体符合上气道狭窄的表现,多导睡眠监测法(PSG)检查每夜7 h睡眠过程中呼吸暂停及低通气反复发作30次以上, 或睡眠呼吸暂停和低通气指数≥5次/h且呼吸暂停以阻塞性为主的患者即可诊断为OSAHS。受试者排除标准:①未满18周岁;②患有严重心肺疾病;③服用过降脂药物;④有全身性激素疗法替代史;⑤曾有CPAP或OSHS手术治疗史;⑥肝肾功能不全;⑦严重精神类疾病。
1.3 多导睡眠监测OSAHS组患者均采用夜间7 h睡眠监测,记录内容包括口鼻气流、胸腹运动、心率、血氧、脑电图,监测结果由医技人员判定后读出。在行监测的当晚不能饮用酒精、咖啡、镇静、降压类药物。
1.4 BMI测量观察对象均测量身高、体质量,通过公式计算BMI, BMI=体质量(kg)/身高2(m2)。
1.5 标本采集观察对象均于清晨空腹抽取静脉血5 mL检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.6 颈动脉超声OSAHS组患者均行颈动脉超声,记录双侧颈动脉内膜中层厚度值(IMT)并计算平均值,记录是否存在颈动脉斑块。
1.7 统计学处理采用SPSS 21.0统计软件。计量资料采用x±s表示,各组间BMI、TG、TC、HDL-C、LDL-C的比较采用单因素方差分析,两两比较采用LSD-t检验,不同OSAHS组患者颈动脉斑块发生率的比较采用χ2检验,OSAHS组患者IMT与AHI、最低SpO2、平均SpO2的关系呈直线变化趋势,采用Pearson简单直线相关分析。检验水准α=0.05, P<0.05为差异有统计学意义。
2 结果 2.1 各OSAHS组与对照组BMI、TG、TC、HDL-C、LDL-C的比较与对照组相比,各OSAHS组BMI均升高,HDL-C均降低,差异有统计学意义。重度和极重度OSAHS组TG较对照组升高,差异有统计学意义。极重度组BMI较重度组升高,差异有统计学意义,TC及LDL-C的差异无统计学意义。见表 1。
| 表 1 各OSAHS组与对照组血脂指标的比较(x±s) Table 1 Comparison of lipid indexes between OSAHS groups and the control group(x±s) |
OSAHS患者的IMT与AHI呈正相关(r=0.316, P=0.001),与平均SpO2呈负相关(r=-0.233, P=0.020),与最低SpO2无明显相关性(r=-0.168, P=0.096)。见图 1。
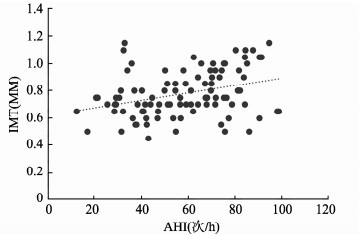
|
图 1 AHI与IMT相关性散点图 Figure 1 The correlation between the IMT and AHI in OSAHS group |
极重度OSAHS患者的斑块发生率高于轻中度患者(χ2=4.045,P=0.044)和重度患者(χ2=6.351,P=0.012)。重度患者与轻中度患者的斑块发生率比较,差异无统计学意义(χ2=3.338, P=0.561)。见表 2。
| 表 2 不同程度OSAHS组患者颈动脉斑块发生率比较[n(%)] Table 2 The incidence rate of carotid artery plaque between different severity OSAHS groups[n(%)] |
OSAHS是由于睡眠时上气道反复发生塌陷阻塞引起的呼吸暂停和通气不足,可导致低氧和高碳酸血症,从而使机体发生一系列病理生理改变的临床综合征,并伴有打鼾、睡眠结构紊乱,白天嗜睡等病症。OSAHS具有潜在危险性,是多种疾病的独立危险因素,越来越受到多学科的重视。
肥胖的病理生理基础是脂代谢紊乱,本研究中,OSAHS患者BMI高于对照组,且极重度OSAHS患者BMI升高更为显著,提示OSAHS患者可能存在血脂代谢紊乱。脂类的代谢过程主要分为脂类合成异常和脂类清除异常。脂类合成主要是在肝脏中进行,TG合成主要涉及胆固醇调节元件结合蛋白(sterol regulatory element binding protein, SREBP-1/SCD-1)通路, 而缺氧诱导因子(HIF-1α)是调控该通路的关键因子。Castillo等[3]通过建立低氧大鼠模型测得低氧组大鼠HIF-1α较常氧组升高,SREBP-1较常氧组降低,可见在间歇性低氧环境中,HIF-1的上调通路激活,使SREBP-1的表达降低,体内TG升高。脂类清除依赖于生物学功能正常的脂蛋白酯酶(lipoprteinlipase, LPL)。由于机体的需要,储藏在脂肪细胞中的TG可以被水解为甘油和脂肪酸为非脂肪细胞所利用,餐后,LPL的活化可促进TG的水解, 从而升高脂肪细胞中脂肪酸的含量[4],国内学者通过将218例经PSG监测的患者按照AHI分组,测得AHI越大,血清LPL水平越低,且重度OSAHS组显著低于单纯鼾症组[5]。本研究中,重度与极重度OSAHS患者TG升高显著,轻度患者未见明显升高,可见疾病的严重程度与血脂代谢紊乱相关,符合上述机制。
已有大样本的临床试验证实在两组非肥胖人群中,OSAHS组动脉粥样硬化性心脏病(atherosclerotic cardiovascular disease, ASCVD)的患病率显著高于对照组[6],提示OSAHS与心血管疾病的发病相关。ASCVD的病理基础是动脉粥样硬化(AS),IMT增厚是早期反应AS的无创指标[7], 本研究中,以AHI作为OSAHS患者夜间睡眠时间歇性缺氧程度的评判标准,分析得AHI与IMT成正向相关,且极重度OSAHS患者颈动脉内膜斑块发生率显著升高,提示OSAHS可影响颈动脉内膜斑块的形成。动脉粥样斑块是由于在动脉内皮损伤的基础上脂质沉积于血管内皮下形成的,OSAHS机体在夜间发生反复低氧时,可使交感神经系统激活,从而使肾素-血管紧张素系统持续激活,导致外周血管收缩、醛固酮分泌增加,从而引起血管内皮功能紊乱,发生血管内皮的损伤,加速斑块形成[8]。此外,HDL-C可逆向转运动脉内皮下巨噬细胞中过多的胆固醇至肝脏参与代谢,是动脉粥样硬化的保护因素[9]。所以,除间歇性缺氧对机体交感神经的激活之外,OSAHS患者HDL-C水平的降低,可能是促进OSAHS患者颈动脉斑块形成的重要原因之一。
本研究表明,OSAHS患者机体存在脂代谢异常,以血清TG升高,HDL-C降低最为显著,OSAHS与颈动脉内膜厚度相关且极重度OSAHS患者颈动脉内膜粥样斑块发生率显著升高。研究结果对临床医师提高认识,做到早期监测,早期干预,从而降低OSAHS患者心血管疾病的发病率及死亡率有重要意义。
OSAHS是全身性疾病,本研究未把相关并发症如高血压、肾脏疾病列入研究范围,可能使研究结果存在偏倚,今后将通过纳入相关对照组来进一步讨论。
| [1] | Drager L F, Li J, Shin M K, et al. Intermittent hypoxia inhibits clearance of triglyceride-rich lipoproteins and inactivates adipose lipoprotein lipase in a mouse model of sleep apnoea[J]. Eur Heart J , 2012, 33 (6) : 783–790. DOI:10.1093/eurheartj/ehr097 |
| [2] | 何权瀛, 肖水芳, 刘大波, 等. 对阻塞性睡眠呼吸暂停低通气综合征诊疗标准(杭州标准)的讨论[J]. 中国耳鼻咽喉头颈外科 , 2006, 13 (7) : 427–430. |
| [3] | Castillo R L, Zepeda A B, Short S E, et al. Protective effects of polyunsatutared fatty acids supplementation against testicular damage induced by intermittent hypobaric hypoxia in rats[J]. J Biomed Sci , 2015, 23 (22) : 8. |
| [4] | Mahat B, Chassé É, Mauger J F, et al. Effects of acute hypoxia on human adipose tissue lipoprotein lipase activity and lipolysis[J]. J Transl Med , 2016, 14 (1) : 212. DOI:10.1186/s12967-016-0965-y |
| [5] | Li J, Zhang Y, Wang J, et al. Association between serum lipoprotein lipase level and dyslipidemia in patients with obstructive sleep apnea syndrome[J]. Zhonghua Yi Xue Za Zhi , 2014, 94 (6) : 403–407. |
| [6] | Cao Z, Zhang P, He Z, et al. Obstructive sleep apnea combined dyslipidemia render additive effect on increasing atherosclerotic cardiovascular diseases prevalence[J]. Lipids Health Dis , 2016, 15 (1) : 98. DOI:10.1186/s12944-016-0267-7 |
| [7] |
莫莉, 姜健, 华建江.
ST2、hs-CRP、IMT与颈动脉粥样硬化相关性研究[J]. 热带医学杂志 , 2014, 14 (6) : 771–773.
MO Li, JIANG Jian, HUA Jianjiang. The correlation of ST2, hs-CRP, carotid intima-media thickness and carotid atherosclerosis[J]. J Trop Med , 2014, 14 (6) : 771–773. |
| [8] |
高辉, 宋盛华, 董旭, 等.
阻塞性睡眠呼吸暂停低通气综合征对青年高血压患者左心室结构、颈动脉IMT和baPWV的影响[J]. 岭南心血管病杂志 , 2015, 21 (3) : 365–368.
GAO Hui, SONG Shenghua, DONG Xu, et al. Effect of obstructive sleep apnea-hypopnea syndrome on left ventricular structure, carotid artery IMT and baPWV in young patients with essential hypertension[J]. South Chin J Cardiovasc Dis , 2015, 21 (3) : 365–368. |
| [9] |
钱怡宁, 王拥军, 刘改芬.
低高密度脂蛋白胆固醇血症对缺血性脑卒中患者一年预后的影响[J]. 中华老年心脑血管病杂志 , 2014, 16 (7) : 676–681.
QIAN Yining, WANG Yongjun, LIU Gaifen, et al. Effect of low HDL-C on one-year outcome in patients with acute ischemic stroke[J]. J Geria Heart Brain Vessel Dis , 2014, 16 (7) : 676–681. |
 2016, Vol. 30
2016, Vol. 30

